题目内容
19.已知氮气和氧气发生化合反应的能量变化图象如图所示.下列推断正确的是( )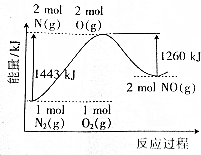
| A. | 氮气和氧气的反应是氧化还原反应,也是放热反应 | |
| B. | 1molNO分子被拆成原子要放出630kJ能量 | |
| C. | 1molN2(g)和1molO2(g)完全反应生成2molNO(g)时吸收183kJ能量 | |
| D. | 在酒精灯加热条件下,N2和O2能发生化合反应生成NO |
分析 A.反应过程中元素化合价变化的为氧化还原反应,图象中可知反应物能量高于生成物能量,属于吸热反应;
B.分子拆成原子是断裂化学键过程属于吸热过程;
C.反应焓变=反应物总键能-生成物总键能;
D.氮气和氧气反应的条件是放电;
解答 解:A.氮气和氧气反应生成一氧化氮是氧化还原反应,图象中可知反应物能量高于生成物能量,属于吸热反应,故A错误;
B.分子拆成原子是断裂化学键过程属于吸热过程,图象可知1molNO分子被拆成原子要吸收630kJ能量,故B错误;
C.1molN2(g)和1molO2(g)完全反应生成2molNO(g)时吸收热量=1443KJ/mol-1260KJ/mol=183kJ/mol,故C正确;
D.氮气和氧气反应的条件是放电,点燃不能发生反应,故D错误;
故选C.
点评 本题考查了化学反应能量变化、反应焓变及其氧化还原反应的分析判断,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7. 钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
当通过1m3烟气时,将吸收瓶1中的吸收液转移至锥形瓶1中,加入1~3滴钍指示剂,以0.025 00mol•L-1的Ba(ClO4)2标准液滴定至终点,消耗Ba(ClO4)2溶液20.00mL;将吸收瓶2、3中的吸收液转移至1 000mL容量瓶中并定容,取50.00mL至锥形瓶2中,加入40mL异丙醇,加入1~3滴钍指示剂,以0.025 00mol•L-1的Ba(ClO4)2标准液滴定至终点,消耗Ba(ClO4)2溶液30.00mL[已知:Ba(ClO4)2+H2SO4═BaSO4↓+2HClO4].
(1)将吸收瓶放入冰水箱中的目的是降温,增大气体的溶解度,使SO2、SO3易被吸收.
(2)100g 6.8%(质量分数)的H2O2溶液最多能吸收4.48 L(标准状况)SO2.
(3)当溶液中SO42-完全沉淀[c(SO42-)≤1.0×10-6 mol•L-1]时,c(Ba2+)≥1.1×10-4 mol/L[室温下,Ksp(BaSO4)=1.1×10-10].
(4)根据以上数据计算烟气中SO3、SO2的质量浓度ρρ(SO3)=40 mg•m-3,ρ(SO2)=960 mg•m-3(mg•m-3)(请给出计算过程).
 钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.| 吸收瓶 | 1 | 2 | 3 |
| 试剂 | 50mL | ||
| 异丙醇 | 50mL 6.8% | ||
| H2O2溶液 | 50mL 6.8% | ||
| H2O2溶液 | |||
| 目的 | 吸收SO3 | 吸收SO2 |
(1)将吸收瓶放入冰水箱中的目的是降温,增大气体的溶解度,使SO2、SO3易被吸收.
(2)100g 6.8%(质量分数)的H2O2溶液最多能吸收4.48 L(标准状况)SO2.
(3)当溶液中SO42-完全沉淀[c(SO42-)≤1.0×10-6 mol•L-1]时,c(Ba2+)≥1.1×10-4 mol/L[室温下,Ksp(BaSO4)=1.1×10-10].
(4)根据以上数据计算烟气中SO3、SO2的质量浓度ρρ(SO3)=40 mg•m-3,ρ(SO2)=960 mg•m-3(mg•m-3)(请给出计算过程).
14.某元素R,其原子最外层比次外层多一个电子,则其含氧酸的化学式不可能是( )
| A. | HRO2 | B. | H3RO3 | C. | H2RO4 | D. | H2R4O7 |
4.天冬酰苯丙氨酸甲酯的结构简式为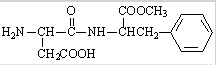 关于该有机物的说法不正确的是( )
关于该有机物的说法不正确的是( )
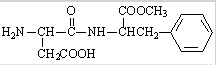 关于该有机物的说法不正确的是( )
关于该有机物的说法不正确的是( )| A. | 在适当催化剂作用下可形成高分子化合物 | |
| B. | 该有机物完全燃烧时生成CO2、H2O、NH3 | |
| C. | 1mol该有机物在盐酸中发生水解反应时最多消耗2molH+ | |
| D. | 1mol该有机物最多能与3molNaOH反应 |
8.设NA为阿伏加德罗常数的值,下列说法的是( )
| A. | 42g环丙烷和丙烯的混合气体中氢原了数目一定为6NA | |
| B. | 1L 0.1mol/L的NH4NO3溶液中原子数少于0.2NA | |
| C. | 在常温常压下,22.4LHF所含分子数为NA | |
| D. | 5.6gFe与足量的水蒸气完全反应,转移电子的数目为0.2NA |
18.室温下,将10mLpH=3的醋酸溶液加水稀释后,下列说法不正确是( )
| A. | 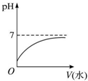 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 溶液中导电粒子的数目增加 | |
| D. | 再加入10 mL pH=11的NaOH溶液,恰好完全中和 |
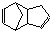 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中.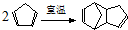 ,反应类型为加成反应;
,反应类型为加成反应;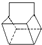 )是双环戊二烯的一种同分异构体,它的一氯代物有4种.
)是双环戊二烯的一种同分异构体,它的一氯代物有4种.