题目内容
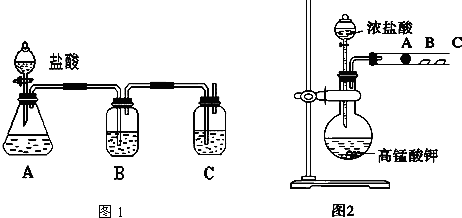
16.下面是几位同学在检验溴乙烷中含有溴元素的记录,其中正确的是( )| A. | 溴乙烷$\stackrel{AgNO_{3}溶液}{→}$浅黄↓ | |
| B. | 溴乙烷$→_{HNO_{3}}^{AgNO_{3}}$浅黄↓ | |
| C. | 溴乙烷$→_{△}^{NaOH和水}$$→_{AgNO_{3}溶液}^{HNO_{3}}$浅黄↓ | |
| D. | 溴乙烷$→_{△}^{NaOH和乙醇}$$\stackrel{AgNO_{3}溶液}{→}$浅黄↓ |
分析 检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成.
解答 解:溴乙烷为非电解质,不能电离出溴离子,检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,只有C正确,
故选C.
点评 本题考查溴乙烷的性质,题目难度中等,易错点为卤代烃水解是碱性溶液中进行,加硝酸银时必须先加酸中和碱才能出现溴化银沉淀,注意实验的操作步骤.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.醋酸的下列性质中可以证明它是弱电解质的是( )
| A. | 醋酸与水以任意比例互溶 | |
| B. | 10 mL 1 mol•L-1醋酸恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| C. | 1 mol•L-1的醋酸溶液的c(H+)约为0.01 mol•L-1 | |
| D. | 在相同浓度下,醋酸的导电性比一元强酸溶液的弱 |
7. 钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
当通过1m3烟气时,将吸收瓶1中的吸收液转移至锥形瓶1中,加入1~3滴钍指示剂,以0.025 00mol•L-1的Ba(ClO4)2标准液滴定至终点,消耗Ba(ClO4)2溶液20.00mL;将吸收瓶2、3中的吸收液转移至1 000mL容量瓶中并定容,取50.00mL至锥形瓶2中,加入40mL异丙醇,加入1~3滴钍指示剂,以0.025 00mol•L-1的Ba(ClO4)2标准液滴定至终点,消耗Ba(ClO4)2溶液30.00mL[已知:Ba(ClO4)2+H2SO4═BaSO4↓+2HClO4].
(1)将吸收瓶放入冰水箱中的目的是降温,增大气体的溶解度,使SO2、SO3易被吸收.
(2)100g 6.8%(质量分数)的H2O2溶液最多能吸收4.48 L(标准状况)SO2.
(3)当溶液中SO42-完全沉淀[c(SO42-)≤1.0×10-6 mol•L-1]时,c(Ba2+)≥1.1×10-4 mol/L[室温下,Ksp(BaSO4)=1.1×10-10].
(4)根据以上数据计算烟气中SO3、SO2的质量浓度ρρ(SO3)=40 mg•m-3,ρ(SO2)=960 mg•m-3(mg•m-3)(请给出计算过程).
 钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.| 吸收瓶 | 1 | 2 | 3 |
| 试剂 | 50mL | ||
| 异丙醇 | 50mL 6.8% | ||
| H2O2溶液 | 50mL 6.8% | ||
| H2O2溶液 | |||
| 目的 | 吸收SO3 | 吸收SO2 |
(1)将吸收瓶放入冰水箱中的目的是降温,增大气体的溶解度,使SO2、SO3易被吸收.
(2)100g 6.8%(质量分数)的H2O2溶液最多能吸收4.48 L(标准状况)SO2.
(3)当溶液中SO42-完全沉淀[c(SO42-)≤1.0×10-6 mol•L-1]时,c(Ba2+)≥1.1×10-4 mol/L[室温下,Ksp(BaSO4)=1.1×10-10].
(4)根据以上数据计算烟气中SO3、SO2的质量浓度ρρ(SO3)=40 mg•m-3,ρ(SO2)=960 mg•m-3(mg•m-3)(请给出计算过程).
4.天冬酰苯丙氨酸甲酯的结构简式为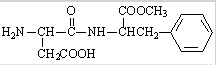 关于该有机物的说法不正确的是( )
关于该有机物的说法不正确的是( )
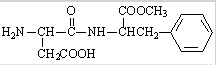 关于该有机物的说法不正确的是( )
关于该有机物的说法不正确的是( )| A. | 在适当催化剂作用下可形成高分子化合物 | |
| B. | 该有机物完全燃烧时生成CO2、H2O、NH3 | |
| C. | 1mol该有机物在盐酸中发生水解反应时最多消耗2molH+ | |
| D. | 1mol该有机物最多能与3molNaOH反应 |
8.设NA为阿伏加德罗常数的值,下列说法的是( )
| A. | 42g环丙烷和丙烯的混合气体中氢原了数目一定为6NA | |
| B. | 1L 0.1mol/L的NH4NO3溶液中原子数少于0.2NA | |
| C. | 在常温常压下,22.4LHF所含分子数为NA | |
| D. | 5.6gFe与足量的水蒸气完全反应,转移电子的数目为0.2NA |
14.下列说法正确的是( )
| A. | 一定温度下,将氨水稀释,NH3?H2O 的电离度增大,H2O 的电离度也增大 | |
| B. | 水中加酸加碱都会阻碍水的电离,所以 c(H+)?c(OH-)<10-14 | |
| C. | 水中加酸,阻碍水的电离,所以 c(H+)=c(OH-)<10-7 mol•L-1 | |
| D. | 醋酸溶液加水稀释,溶液中所有微粒的浓度都会降低 |