题目内容
18.在一密闭容器中反应2SO2+O2?2SO3经5秒后,SO3的浓度增加了0.4mol•L-1,则在这段时间内用O2表示的反应速率为0.04 mol•L-1•s-1.分析 根据v=$\frac{△c}{△t}$计算v(SO3),再根据速率之比等于化学计量数之比计算v(O2).
解答 解:5s内SO3的浓度增加了0.4mol/L,所以v(SO3)=$\frac{0.4mol/L}{5s}$=0.08mol/(L•s),速率之比等于化学计量数之比,所以
v(O2)=$\frac{1}{2}$v(SO3)=$\frac{1}{2}$×0.08mol/(L•s)=0.04mol/(L•s).
故答案为:0.04;
点评 本题考查化学反应速率的计算,难度不大,化学反应速率计算可用定义法,也可用化学计量数法,根据情况选择合适的方法.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
8. 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
(1)该小组同学向5mLlmol/LFeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(2)向5mLlmol/LFeCl3溶液中通人足量的SO2,在实验时,溶液由棕黄色变成红棕色,最终溶液呈浅绿色.
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色,能被Fe3+氧化为SO${\;}_{4}^{2-}$.
Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为缩短红棕色变为浅绿色的时间,进行了如下实验:
向步骤①和步骤②所得溶液中滴加K3[Fe(CN)6](添化学式)试剂,溶液立即出现蓝色沉淀.
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间.
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:(1)该小组同学向5mLlmol/LFeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(2)向5mLlmol/LFeCl3溶液中通人足量的SO2,在实验时,溶液由棕黄色变成红棕色,最终溶液呈浅绿色.
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色,能被Fe3+氧化为SO${\;}_{4}^{2-}$.
Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为缩短红棕色变为浅绿色的时间,进行了如下实验:
向步骤①和步骤②所得溶液中滴加K3[Fe(CN)6](添化学式)试剂,溶液立即出现蓝色沉淀.
| 步骤① | 往5mL1mol/LFeCl3溶液中通入SO2气体,溶液立即变为红棕色,微热在较短时间内溶液颜色变为浅绿色. |
| 步骤② | 往5mL重新配制的1mol/LFeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色,短时间内溶液颜色变为浅绿色. |
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间.
6.醋酸的下列性质中可以证明它是弱电解质的是( )
| A. | 醋酸与水以任意比例互溶 | |
| B. | 10 mL 1 mol•L-1醋酸恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| C. | 1 mol•L-1的醋酸溶液的c(H+)约为0.01 mol•L-1 | |
| D. | 在相同浓度下,醋酸的导电性比一元强酸溶液的弱 |
13.某溶液中Cl-、Br-、I-的物质的量之比为2:3:4.要使溶液中的Cl-、Br-、I-的物质的量之比变为4:3:2,则通入Cl2的物质的量与原溶液中I-的物质的量之比为( )
| A. | 4:1 | B. | 2:1 | C. | 1:4 | D. | 1:2 |
3.某短周期元素X,其原子的电子层数为n,最外层电子数为(2n+l),原子核内质子数是(2n2一l).下列有关X的说法,不正确的是( )
| A. | X是非金属元素 | |
| B. | X形成含氧酸钾盐化学式可能为KXO2、KXO3或KXO4 | |
| C. | 由X形成的含氧酸均为强酸 | |
| D. | X不可能为第一周期元素 |
7. 钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
当通过1m3烟气时,将吸收瓶1中的吸收液转移至锥形瓶1中,加入1~3滴钍指示剂,以0.025 00mol•L-1的Ba(ClO4)2标准液滴定至终点,消耗Ba(ClO4)2溶液20.00mL;将吸收瓶2、3中的吸收液转移至1 000mL容量瓶中并定容,取50.00mL至锥形瓶2中,加入40mL异丙醇,加入1~3滴钍指示剂,以0.025 00mol•L-1的Ba(ClO4)2标准液滴定至终点,消耗Ba(ClO4)2溶液30.00mL[已知:Ba(ClO4)2+H2SO4═BaSO4↓+2HClO4].
(1)将吸收瓶放入冰水箱中的目的是降温,增大气体的溶解度,使SO2、SO3易被吸收.
(2)100g 6.8%(质量分数)的H2O2溶液最多能吸收4.48 L(标准状况)SO2.
(3)当溶液中SO42-完全沉淀[c(SO42-)≤1.0×10-6 mol•L-1]时,c(Ba2+)≥1.1×10-4 mol/L[室温下,Ksp(BaSO4)=1.1×10-10].
(4)根据以上数据计算烟气中SO3、SO2的质量浓度ρρ(SO3)=40 mg•m-3,ρ(SO2)=960 mg•m-3(mg•m-3)(请给出计算过程).
 钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.| 吸收瓶 | 1 | 2 | 3 |
| 试剂 | 50mL | ||
| 异丙醇 | 50mL 6.8% | ||
| H2O2溶液 | 50mL 6.8% | ||
| H2O2溶液 | |||
| 目的 | 吸收SO3 | 吸收SO2 |
(1)将吸收瓶放入冰水箱中的目的是降温,增大气体的溶解度,使SO2、SO3易被吸收.
(2)100g 6.8%(质量分数)的H2O2溶液最多能吸收4.48 L(标准状况)SO2.
(3)当溶液中SO42-完全沉淀[c(SO42-)≤1.0×10-6 mol•L-1]时,c(Ba2+)≥1.1×10-4 mol/L[室温下,Ksp(BaSO4)=1.1×10-10].
(4)根据以上数据计算烟气中SO3、SO2的质量浓度ρρ(SO3)=40 mg•m-3,ρ(SO2)=960 mg•m-3(mg•m-3)(请给出计算过程).
8.设NA为阿伏加德罗常数的值,下列说法的是( )
| A. | 42g环丙烷和丙烯的混合气体中氢原了数目一定为6NA | |
| B. | 1L 0.1mol/L的NH4NO3溶液中原子数少于0.2NA | |
| C. | 在常温常压下,22.4LHF所含分子数为NA | |
| D. | 5.6gFe与足量的水蒸气完全反应,转移电子的数目为0.2NA |
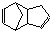 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中.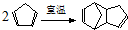 ,反应类型为加成反应;
,反应类型为加成反应;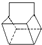 )是双环戊二烯的一种同分异构体,它的一氯代物有4种.
)是双环戊二烯的一种同分异构体,它的一氯代物有4种.