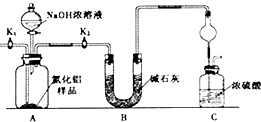
题目内容
3.现有相同质量的①乙醇、②乙二醇、③丙三醇,请依照下列要求进行排序.(填序号)(1)燃烧后生成二氧化碳的量由多到少:①>③>②;
(2)燃烧时耗用氧气的量由多到少:①>②>③;
(3)与足量金属钠反应放出氢气的量由多到少:③>②>①.
分析 (1)根据碳元素守恒,碳元素质量分数越大,燃烧生成二氧化碳的量越大;
(2)令各有机物的质量均为1g,求出其物质的量,1mol CxHyOz耗氧量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol;
(3)羟基的质量分数越大,生成氢气的量越大.
解答 解:(1)碳元素质量分数越大,燃烧生成二氧化碳的量越大,分子式依次为C2H6O、C2H6O2、C3H8O3,碳元素质量分数为:乙醇>丙三醇>乙二醇,故相同质量完全燃烧,生成二氧化碳的量:①>③>②,
故答案为:①>③>②;
(2)1mol CxHyOz耗氧量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol,令各有机物的质量均为1g,
C2H6O的物质的量为$\frac{1}{46}$mol,则反应消耗的氧气为$\frac{1}{46}$×3=$\frac{3}{46}$mol≈0.065mol,
C2H6O2的物质的量为mol,则反应消耗的氧气为$\frac{1}{62}$mol×2.5=$\frac{2.5}{62}$mol≈0.04,
C3H8O3的物质的量为$\frac{1}{92}$mol,则反应消耗的氧气为$\frac{1}{92}$mol×3.5=$\frac{3.5}{92}$mol≈0.038,
故答案为:①>②>③;
(3)羟基的质量分数越大,生成氢气的量越大,羟基质量分数:丙三醇>乙二醇>乙醇,故生成氢气的量为:③>②>①,
故答案为:③>②>①.
点评 本题考查了烃的含氧衍生物完全燃烧耗氧量问题,难度不大,注意有机物燃烧规律的总结.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
13.某溶液中Cl-、Br-、I-的物质的量之比为2:3:4.要使溶液中的Cl-、Br-、I-的物质的量之比变为4:3:2,则通入Cl2的物质的量与原溶液中I-的物质的量之比为( )
| A. | 4:1 | B. | 2:1 | C. | 1:4 | D. | 1:2 |
14.某元素R,其原子最外层比次外层多一个电子,则其含氧酸的化学式不可能是( )
| A. | HRO2 | B. | H3RO3 | C. | H2RO4 | D. | H2R4O7 |
18.下列说法不正确的是( )
| A. | 某芳香烃的分子式为C10H14,不能使溴水因反应而褪色,苯环上只有一个取代基,符合条件的烃有4种 | |
| B. | 按照系统命名法,有机物 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 | |
| C. | 甲烷、甲醛、甲酸甲脂都不存在同分异构体 | |
| D. | 某有机物含有C、H、O、N四种元素,其球棍模型为 该有机物能发生取代反应 该有机物能发生取代反应 |
8.设NA为阿伏加德罗常数的值,下列说法的是( )
| A. | 42g环丙烷和丙烯的混合气体中氢原了数目一定为6NA | |
| B. | 1L 0.1mol/L的NH4NO3溶液中原子数少于0.2NA | |
| C. | 在常温常压下,22.4LHF所含分子数为NA | |
| D. | 5.6gFe与足量的水蒸气完全反应,转移电子的数目为0.2NA |
4.根据下列流程处理废旧电路板,回收金属M,并制得高效绿色净水剂K2EO4.
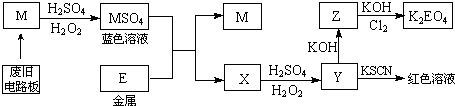
据此回答问题:
(1)M的化学式是Cu.
(2)M→MSO4过程中,氧化剂是H2O2,还原剂是Cu.
(3)写出Z→K2EO4的化学反应方程式:2Fe(OH)3+10KOH+3Cl2=2K2FeO4+8H2O+6KCl.
(4)向Y溶液中滴加KI淀粉溶液,变为蓝色,其原因用离子方程式解释为:2Fe3++2I-═2Fe2++I2.
(5)控制其他条件相同,印刷电路板的金属 M用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下金属M的平均溶解速率(见下表).
当温度高于40℃时,M的平均溶解速率随着反应温度升高而下降,其主要原因是过氧化氢分解浓度降低造成速率减慢.

据此回答问题:
(1)M的化学式是Cu.
(2)M→MSO4过程中,氧化剂是H2O2,还原剂是Cu.
(3)写出Z→K2EO4的化学反应方程式:2Fe(OH)3+10KOH+3Cl2=2K2FeO4+8H2O+6KCl.
(4)向Y溶液中滴加KI淀粉溶液,变为蓝色,其原因用离子方程式解释为:2Fe3++2I-═2Fe2++I2.
(5)控制其他条件相同,印刷电路板的金属 M用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下金属M的平均溶解速率(见下表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| V(M)(x10-3mol.L-1.min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |