题目内容
氨在国民经济中占有重要地位.
(1)工业合成氨时,合成塔中每产生1mol NH3,放出46.1kJ的热量.①工业合成氨的热化学方程式是 .②已知:N2(g)
2N(g) H2(g)
2H(g)则断开1mol N-H键所需的能量是 kJ.
(2)如图1是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.①曲线a对应的温度是 .②关于工业合成氨的反应,下列叙述正确的是 (填字母).A.及时分离出NH3可以提高H2的平衡转化率 B.加催化剂能加快反应速率且提高H2的平衡转化率 C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③M点对应的H2转化率是 .
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,如图2.电池的总反应为:4NH3(g)+3O2(g)═2N2(g)+6H2O(g).则该燃料电池的负极反应式是 .

(1)工业合成氨时,合成塔中每产生1mol NH3,放出46.1kJ的热量.①工业合成氨的热化学方程式是
| 436.0kJ?mol-1 |
| 945.8kJ?mol-1 |
(2)如图1是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.①曲线a对应的温度是
③M点对应的H2转化率是
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,如图2.电池的总反应为:4NH3(g)+3O2(g)═2N2(g)+6H2O(g).则该燃料电池的负极反应式是
考点:热化学方程式,常见化学电源的种类及其工作原理,化学平衡的影响因素
专题:化学平衡专题,电化学专题
分析:(1)①先求出此反应的焓变,根据热化学方程式的书写规则再写出热化学方程式;
②根据反应热等于反应物的总键能减去生成物的总键能计算;
(2)①依据反应是放热反应,温度升高,平衡逆向进行,氨气的含量减小;
②依据化学平衡影响因素的分析,普华永道原理的应用判断选项;
③M点氨气的物质的量为60%,剩余40%,按照反应物反应比1:3,投料剩余氢气30%,依据化学方程式计算可知反应的氢气90%.依据转化率概念计算;
(3)依据氧化还原反应元素化合价变化分析判断,电池中负极上是氨气失电子生成氮气的反应;
②根据反应热等于反应物的总键能减去生成物的总键能计算;
(2)①依据反应是放热反应,温度升高,平衡逆向进行,氨气的含量减小;
②依据化学平衡影响因素的分析,普华永道原理的应用判断选项;
③M点氨气的物质的量为60%,剩余40%,按照反应物反应比1:3,投料剩余氢气30%,依据化学方程式计算可知反应的氢气90%.依据转化率概念计算;
(3)依据氧化还原反应元素化合价变化分析判断,电池中负极上是氨气失电子生成氮气的反应;
解答:
解:(1)①反应物总能量大于生成物总能量,应为放热反应,生成1mol氨气放出46.1kJ热量,则反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
②反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则945.8+3×436-6x=-92.2,x=391;
故答案为:391;
(2)①合成氨的反应为放热反应,反应温度越高,越不利于反应的进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200°C;
故答案为:200°C;
②A.及时分离出NH3,可以使平衡正向进行,可以提高H2的平衡转化率,故A正确;
B.加催化剂能加快反应速率,但不能提高H2的平衡转化率,故B错误;
C.平衡常数与温度有关,与其他条件无关,同一温度下的平衡常数相同,反应是放热反应,温度越高平衡常数越小,上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故C正确;
故答案为:AC.
③在M点氨气的物质的量为60%,剩余40%,因为反应器中按n(N2):n(H2)=1:3投料,故剩余氢气物质的量为30%,因为N2(g)+3H2(g)?2NH3(g),即发生反应的氢气物质的量90%,所以M点对应氢气的转化率=
×100%=75%;
故答案为:75%;
(3)原电池中负极失电子,氨气中氮元素化合价升高,发生氧化反应,该燃料电池的负极电极反应为:2NH3-6e-+6OH-=N2+6H2O;
故答案为:2NH3-6e-+6OH-=N2+6H2O;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
②反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则945.8+3×436-6x=-92.2,x=391;
故答案为:391;
(2)①合成氨的反应为放热反应,反应温度越高,越不利于反应的进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200°C;
故答案为:200°C;
②A.及时分离出NH3,可以使平衡正向进行,可以提高H2的平衡转化率,故A正确;
B.加催化剂能加快反应速率,但不能提高H2的平衡转化率,故B错误;
C.平衡常数与温度有关,与其他条件无关,同一温度下的平衡常数相同,反应是放热反应,温度越高平衡常数越小,上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故C正确;
故答案为:AC.
③在M点氨气的物质的量为60%,剩余40%,因为反应器中按n(N2):n(H2)=1:3投料,故剩余氢气物质的量为30%,因为N2(g)+3H2(g)?2NH3(g),即发生反应的氢气物质的量90%,所以M点对应氢气的转化率=
| 90 |
| 90+30 |
故答案为:75%;
(3)原电池中负极失电子,氨气中氮元素化合价升高,发生氧化反应,该燃料电池的负极电极反应为:2NH3-6e-+6OH-=N2+6H2O;
故答案为:2NH3-6e-+6OH-=N2+6H2O;
点评:本题考查了热化学方程式和盖斯定律的分析应用,化学反应能量变化,平衡常数的影响因素分析,原电池原理的理解和电极反应的书写方法,题目难度中等.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
 某原电池的结构如图所示,下列有关该原电池的说法中不正确的是( )
某原电池的结构如图所示,下列有关该原电池的说法中不正确的是( )| A、铁棒为正极 |
| B、铜棒发生还原反应 |
| C、电流从铜棒经外电路流向铁棒 |
| D、铁棒质量减轻 |
能正确表示下列反应的离子方程式是( )
| A、Na2O2与H2O反应:Na2O2+H2O=2Na++2OH-+O2↑ |
| B、硫酸铝与过量氨水反应:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| C、NO2溶于水:3NO2+H2O=2H++2NO3-+NO |
| D、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+ |
图示原电池工作时,叙述正确的是( )
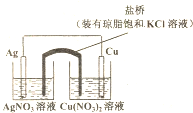

| A、在外电路中,电子由银电极流向铜电极 |
| B、正极反应为:Ag++e-=Ag |
| C、实验过程中取出盐桥,原电池仍能继续工作 |
| D、盐桥中的K+移向Cu(NO3)2溶液 |

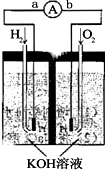 氢氧燃料电池是符合绿色化学理念的新型发电装置.
氢氧燃料电池是符合绿色化学理念的新型发电装置.