题目内容
图示原电池工作时,叙述正确的是( )
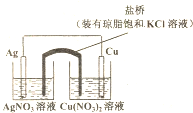

| A、在外电路中,电子由银电极流向铜电极 |
| B、正极反应为:Ag++e-=Ag |
| C、实验过程中取出盐桥,原电池仍能继续工作 |
| D、盐桥中的K+移向Cu(NO3)2溶液 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、外电路中电子是由负极流向正极;
B、装置图中铜做负极,银做正极,溶液中银离子得到电子生成银;
C、盐桥是利用电解质溶液电荷守恒形成闭合回路的作用;
D、依据电解质溶液中电荷守恒分析判断,钾离子移向硝酸银溶液.
B、装置图中铜做负极,银做正极,溶液中银离子得到电子生成银;
C、盐桥是利用电解质溶液电荷守恒形成闭合回路的作用;
D、依据电解质溶液中电荷守恒分析判断,钾离子移向硝酸银溶液.
解答:
解:A、外电路中电子是由负极流向正极,原电池中铜做负极,银做正极,电子由铜电极流向银电极,故A错误;
B、装置图中铜做负极,银做正极,溶液中银离子得到电子生成银,电极反应为Ag++e-=Ag,故B正确;
C、盐桥是利用电解质溶液电荷守恒形成闭合回路的作用,实验过程中取出盐桥,原电池不能继续工作,故C错误;
D、电解质溶液中电荷守恒分析,盐桥中的K+移向硝酸银溶液,故D错误;
故选B.
B、装置图中铜做负极,银做正极,溶液中银离子得到电子生成银,电极反应为Ag++e-=Ag,故B正确;
C、盐桥是利用电解质溶液电荷守恒形成闭合回路的作用,实验过程中取出盐桥,原电池不能继续工作,故C错误;
D、电解质溶液中电荷守恒分析,盐桥中的K+移向硝酸银溶液,故D错误;
故选B.
点评:本题考查了原电池原理的分析应用,主要是电极、电极反应的分析判断,盐桥的作用分析是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在100mL 0.01mol?L-1KCl溶液中,加入1mL 0.01mol?L-1AgNO3溶液,下列说法正确的是(已知AgCl Ksp=1.8×10-10)( )
| A、有沉淀但不是AgCl |
| B、无AgCl沉淀 |
| C、有AgCl沉淀析出 |
| D、无法确定 |
有关CaCO3的溶解平衡的说法中,不正确的是( )
| A、CaCO3沉淀析出和沉淀溶解不断进行,但速率相等 |
| B、CaCO3难溶于水,其饱和溶液几乎不导电,属于弱电解质溶液 |
| C、升高温度,CaCO3沉淀的溶解度增大 |
| D、向CaCO3沉淀中加入纯碱固体,CaCO3的溶解量降低 |
下列说法不正确的是( )
| A、硫酸亚铁铵晶体过滤后用无水乙醇洗涤,阿司匹林晶体过滤后用水洗涤 |
| B、在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在 |
| C、中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 |
| D、纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度慢一些 |
下列离子方程式书写正确的是( )
| A、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、碳酸氢钠溶液与过量石灰水反应:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| C、硝酸铝溶液中加过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| D、向次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
 铜锌原电池工作时,下列叙述正确的是( )
铜锌原电池工作时,下列叙述正确的是( )| A、正极反应为:Zn-2e-=Zn2+ |
| B、在外电路中,电子从Zn 流向Cu |
| C、取走盐桥,外电路灯泡也会亮 |
| D、盐桥中的K+移向ZnSO4溶液 |
 A、B为充满KOH溶液的两只试管.切断K1,合闭K2、K3,通直流电,电解一段时间后A、B中均有气体产生.装置如图.回答下列问题:
A、B为充满KOH溶液的两只试管.切断K1,合闭K2、K3,通直流电,电解一段时间后A、B中均有气体产生.装置如图.回答下列问题: