题目内容
18.常温下用石墨电极,电解100mL 0.1mol•L-1C u(NO3)2和0.1mol•L-1A gNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为1.12L时,假设溶液体积不变,下列说法正确的是( )| A. | 阴极增重1.72g | B. | 所得溶液 pH<1 | C. | 阴极增重0.64g | D. | 所得溶液pH>1 |
分析 用石墨作电极,电解100ml 0.1mol/L的硝酸铜和0.1mol/L的硝酸银组成的混合溶液,阳极上放电的离子为氢氧根离子,阴极上放电的离子为银离子、铜离子、氢离子,依据电极得失电子守恒讨论产生气体在阴极和阳极分别进行计算.
解答 解:100ml 0.1mol/L的硝酸铜和0.1mol/L的硝酸银组成的混合溶液,含有银离子、铜离子各0.01mol,用石墨作电极电解混合液,当某一电极上生成的气体在标准状况下体积为1.12L时:
1、当阴极上生成的气体体积为1.12L即0.05mol,说明银离子、铜离子放电完全,溶液中的氢离子放电生成氢气0.05mol,
阴极:Ag++e-=Ag;Cu2++2e-=Cu;2H++2e-=H2↑,
转移电子数:Ag++e-=Ag; Cu2++2e-=Cu; 2H++2e-=H2↑,
0.01 0.01 0.01 0.01 0.02 0.01 0.1 0.1 0.05
共转移电子数0.01+0.02+0.1=0.13(mol),阴极增重0.01×108+0.01×64=1.72g,故A正确,C错误;
阳极为氢氧根离子放电生成氧气,电极反应式阳极:4OH--4e-=2H2O+O2↑;
4OH--4e-=2H2O+O2↑
0.13 0.13 $\frac{0.13}{4}$
则反应后溶液中的氢离子浓度为$\frac{0.13-0.1}{0.1}$mol/L=0.3mol/L,则所得溶液pH<1,故B正确,D错误.
故选AB.
点评 本题考查了电解池相关计算,明确电解池工作的原理,抓住阴阳两极转移电子守恒是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列物质直接参与的过程与氧化还原反应有关的是( )
| A. | 用乙醚从黄花蒿中提取青蒿素 | |
| B. | 用浸有酸性高锰酸钾的硅藻土作水果保鲜剂 | |
| C. | 生石灰用作煤炭燃烧的固硫剂 | |
| D. | 服用阿司匹林出现水杨酸反应时用小苏打解毒 |
6.下列说法正确的是( )
| A. | 高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 | |
| B. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| C. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度从而增大与氢氧化溶液的接触面积,从而加快油脂皂化反应速率 | |
| D. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 |
13.用MnO2和浓盐酸反应制取氯气时,当有4mol e-转移时,生成的氯气在标准状况下的体积为( )
| A. | 22.4L | B. | 11.2L | C. | 44.8L | D. | 89.6L |
3.一个集气瓶中放有一团棉花,向其中倒入CO2气体时棉花燃烧起来,则棉花中可能包有( )
| A. | 烧碱 | B. | 氧化钠 | C. | 过氧化钠 | D. | 小苏打 |
7.足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入4mol•L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50mL,下列说法正确的是( )
| A. | 消耗氧气的体积为1.68 L | |
| B. | 混合气体中含NO21.12 L | |
| C. | 此反应过程中转移的电子为0.3 mol | |
| D. | 参加反应的硝酸是0.4mol |
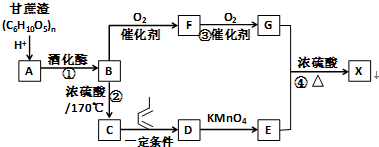
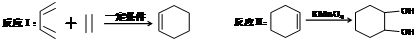
 ,F官能团的名称为醛基,
,F官能团的名称为醛基,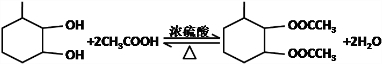 .
. Ⅰ.含六元环Ⅱ.能使溴的四氯化碳溶液褪色
Ⅰ.含六元环Ⅱ.能使溴的四氯化碳溶液褪色 的合成路线为
的合成路线为 .
.

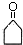
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2
 任意一种.
任意一种.