题目内容
13.用MnO2和浓盐酸反应制取氯气时,当有4mol e-转移时,生成的氯气在标准状况下的体积为( )| A. | 22.4L | B. | 11.2L | C. | 44.8L | D. | 89.6L |
分析 二氧化锰与足量的浓盐酸反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,根据参加反应的盐酸量,结合反应的化学方程式计算.
解答 解:由MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O知生成Cl2跟电子转移的关系为:Cl2~2e-,当有4 mol e-转移时生成Cl2为:$\frac{4mol}{2}$×22.4L•mol-1=44.8L,
故选C.
点评 本题考查实验室制备氯气的原理,题目难度不大,注意根据反应的化学方程式计算.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
8.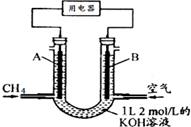 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )| A. | OH-由A端移向B端 | |
| B. | 0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+KOH═KHCO3+2H2O | |
| C. | 22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32-+3H2O=10HCO3- | |
| D. | V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-) |
4.下列关于电解质溶液中粒子浓度关系的说法不正确的是( )
| A. | 0.1 mol/L的NaHCO3溶液中粒子浓度的关系:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| B. | 0.2 mol/L的HCl和0.1 mol/L的NH3•H2O等体积混合后溶液中的离子浓度关系: c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| C. | pH相同的CH3COONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(NaOH) | |
| D. | 0.1 mol/L的NaHS溶液中粒子浓度关系:c(S2-)+c(OH-)=(H+)+c(H2S) |
1.工业上由二氧化锰制备高锰酸钾可分二步进行,第一步:二氧化锰与氢氧化钾共熔并通入氧气2MnO2+4KOH+O2═2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH则下列说法正确的是( )
| A. | 根据上述过程,每生成1molKMnO4,共转移6mol电子 | |
| B. | 第二步电解时,阳极电极反应式为2MnO42--2e-=2MnO4- | |
| C. | 第二步电解的离子方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+OH- | |
| D. | 第二步电解时阴极周围pH减小 |
8.下列关于电解质溶液的叙述正确的是( )
| A. | pH=8.3 的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大 |
18.常温下用石墨电极,电解100mL 0.1mol•L-1C u(NO3)2和0.1mol•L-1A gNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为1.12L时,假设溶液体积不变,下列说法正确的是( )
| A. | 阴极增重1.72g | B. | 所得溶液 pH<1 | C. | 阴极增重0.64g | D. | 所得溶液pH>1 |
5.下列物质不属于同分异构体的是( )
| A. | 葡萄糖和果糖 | B. | 蔗糖和麦芽糖 | ||
| C. | 甘氨酸和硝基乙烷 | D. | 淀粉和纤维素 |
2.某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示.
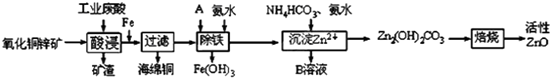
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等).(任写一点即可)
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,
则相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”“<”或“=”).
(3)物质A是用来将ZnSO4溶液中的Fe2+转化为Fe3+最好使用下列物质中的B.
A.KMnO4B.H2O2 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是通过调节溶液的pH,使Fe3+沉淀而Zn2+不沉淀,pH应控制在3.2≤pH<6.2或3.2~6.2范围之间.
(5)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(6)写出最后焙烧生成ZnO的化学反应方程式Zn2(OH)2CO3=2ZnO+H2O+CO2↑.

已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等).(任写一点即可)
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,
则相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”“<”或“=”).
(3)物质A是用来将ZnSO4溶液中的Fe2+转化为Fe3+最好使用下列物质中的B.
A.KMnO4B.H2O2 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是通过调节溶液的pH,使Fe3+沉淀而Zn2+不沉淀,pH应控制在3.2≤pH<6.2或3.2~6.2范围之间.
(5)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(6)写出最后焙烧生成ZnO的化学反应方程式Zn2(OH)2CO3=2ZnO+H2O+CO2↑.
3.下列离子方程式正确的是( )
| A. | 向FeBr2洛液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| B. | Cl2通入水中:Cl2+H20═2H++Cl-+ClO- | |
| C. | 用铜作电极电解CuSO4溶液:2Cu2++2H20═2Cu+O2+4H+ | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使S042-恰好完全沉淀:2Ba2++3OH-+Al3++2S042-═2BaS04+Al(OH)3 |