题目内容
10.下面所列物质中,属于强电解质的是①⑦⑩(填序号,下同),属于弱电解质的是③⑥⑧,属于非电解质的是②④⑤.
①氯化钾 ②乙醇 ③醋酸 ④氨气 ⑤蔗糖 ⑥硫化氢
⑦硫酸氢钠 ⑧一水合氨 ⑨氯气 ⑩碳酸钡⑪铁.
分析 在水溶液中能够完全电离的电解质为强电解质,在溶液中部分电离的电解质为弱电解质,弱电解质存在电离平衡,水溶液中或熔融状态下导电的化合物为电解质,水溶液和熔融状态都不导电的化合物为非电解质,据此进行判断.
解答 解:①氯化钾、③醋酸、⑥硫化氢、⑦硫酸氢钠、⑧一水合氨、⑩碳酸钡水溶液中或熔融状态下能导电,属于电解质,
①氯化钾、⑦硫酸氢钠、⑩碳酸钡水溶液中或熔融状态下完全电离属于强电解质,
③醋酸、⑥硫化氢、⑧一水合氨水溶液中部分电离属于弱电解质,
②乙醇、④氨气、⑤蔗糖水溶液中和熔融状态下都不导电属于非电解质,
⑨氯气⑪铁是单质不是电解质或非电解质,
属于强电解质的为:①⑦⑩,
属于弱电解质的为:③⑥⑧,
属于非电解质的为:②④⑤
故答案为:①⑦⑩;③⑥⑧;②④⑤.
点评 本题考查了电解质、非电解质、强电解质和弱电解质概念的分析,注意物质组成和概念实质的理解应用,题目较简单.

练习册系列答案
相关题目
5.下列有关物质的组成、性质、用途的说法.正确的是( )
①Na2O2中的阳离子和阴离子个数比为1:1
②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性
④NO2,Fe(OH)3,FeC12都能直接通过化合反应制备
⑤H2S能使酸性高锰酸钾溶液褪色.所以它具有漂白性.
①Na2O2中的阳离子和阴离子个数比为1:1
②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性
④NO2,Fe(OH)3,FeC12都能直接通过化合反应制备
⑤H2S能使酸性高锰酸钾溶液褪色.所以它具有漂白性.
| A. | ②③④ | B. | ①②③ | C. | ①②③④ | D. | ①②③⑤ |
1.工业上由二氧化锰制备高锰酸钾可分二步进行,第一步:二氧化锰与氢氧化钾共熔并通入氧气2MnO2+4KOH+O2═2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH则下列说法正确的是( )
| A. | 根据上述过程,每生成1molKMnO4,共转移6mol电子 | |
| B. | 第二步电解时,阳极电极反应式为2MnO42--2e-=2MnO4- | |
| C. | 第二步电解的离子方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+OH- | |
| D. | 第二步电解时阴极周围pH减小 |
18.常温下用石墨电极,电解100mL 0.1mol•L-1C u(NO3)2和0.1mol•L-1A gNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为1.12L时,假设溶液体积不变,下列说法正确的是( )
| A. | 阴极增重1.72g | B. | 所得溶液 pH<1 | C. | 阴极增重0.64g | D. | 所得溶液pH>1 |
5.下列物质不属于同分异构体的是( )
| A. | 葡萄糖和果糖 | B. | 蔗糖和麦芽糖 | ||
| C. | 甘氨酸和硝基乙烷 | D. | 淀粉和纤维素 |
15.设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )
| A. | 标准状况下,22.4 L NH3溶于水后溶液中含有NA个NH4+ | |
| B. | 1L 0.1 mol•L-1的Na2CO3溶液中含有0.2 NA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液中含有0.1NAFe3+ |
2.某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示.
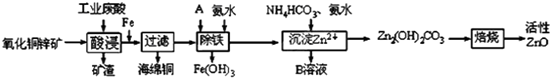
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等).(任写一点即可)
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,
则相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”“<”或“=”).
(3)物质A是用来将ZnSO4溶液中的Fe2+转化为Fe3+最好使用下列物质中的B.
A.KMnO4B.H2O2 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是通过调节溶液的pH,使Fe3+沉淀而Zn2+不沉淀,pH应控制在3.2≤pH<6.2或3.2~6.2范围之间.
(5)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(6)写出最后焙烧生成ZnO的化学反应方程式Zn2(OH)2CO3=2ZnO+H2O+CO2↑.

已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等).(任写一点即可)
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,
则相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”“<”或“=”).
(3)物质A是用来将ZnSO4溶液中的Fe2+转化为Fe3+最好使用下列物质中的B.
A.KMnO4B.H2O2 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是通过调节溶液的pH,使Fe3+沉淀而Zn2+不沉淀,pH应控制在3.2≤pH<6.2或3.2~6.2范围之间.
(5)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(6)写出最后焙烧生成ZnO的化学反应方程式Zn2(OH)2CO3=2ZnO+H2O+CO2↑.
19.下列说法正确的是( )
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使反应速率增大的主要原因是减小了反应物分子中活化分子的百分数 | |
| D. | 催化剂能增大活化分子的百分数,从而成千上万倍地增大反应速率 |
20.下列物质互为同分异构体的是( )
| A. | 金刚石和石墨 | B. | 1H和2H | C. | 氯化氢和盐酸 | D. | 正丁烷和异丁烷 |