题目内容
13.下列物质直接参与的过程与氧化还原反应有关的是( )| A. | 用乙醚从黄花蒿中提取青蒿素 | |
| B. | 用浸有酸性高锰酸钾的硅藻土作水果保鲜剂 | |
| C. | 生石灰用作煤炭燃烧的固硫剂 | |
| D. | 服用阿司匹林出现水杨酸反应时用小苏打解毒 |
分析 A.利用物质的物理性质;
B.高锰酸钾能氧化乙烯;
C.生石灰与二氧化硫反应生成亚硫酸钙;
D.水杨酸显酸性.
解答 解:A.用乙醚从黄花蒿中提取青蒿素,利用物质的溶解性,属于物理性质,与氧化还原反应无关,故A错误;
B.水果释放出的乙烯能催熟水果,高锰酸钾能氧化乙烯,所以用浸有酸性高锰酸钾的硅藻土作水果保鲜剂,与氧化还原反应有关,故B正确;
C.生石灰与二氧化硫反应生成亚硫酸钙,反应中没有元素化合价的变化,与氧化还原反应无关,故C错误;
D.水杨酸显酸性,与小苏打反应,不是氧化还原反应,故D错误.
故选B.
点评 本题以氧化还原反应为载体考查化学与生活,明确物质性质是解本题关键,注意氧化还原反应本质与特征区别,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.已知合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).将体积比为14:13的NH3与CO2的混合气体置于密闭容器中,若反应达到平衡后增大压强,混合气体的平均相对分子质量( )
| A. | 变小 | B. | 不变 | ||
| C. | 增大 | D. | 可能增大、减小,也可能不变 |
1.已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法错误的是( )
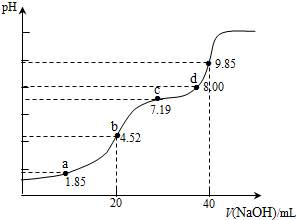

| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(SO32-)=c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
8.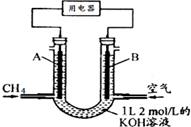 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )| A. | OH-由A端移向B端 | |
| B. | 0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+KOH═KHCO3+2H2O | |
| C. | 22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32-+3H2O=10HCO3- | |
| D. | V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-) |
5.下列有关物质的组成、性质、用途的说法.正确的是( )
①Na2O2中的阳离子和阴离子个数比为1:1
②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性
④NO2,Fe(OH)3,FeC12都能直接通过化合反应制备
⑤H2S能使酸性高锰酸钾溶液褪色.所以它具有漂白性.
①Na2O2中的阳离子和阴离子个数比为1:1
②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性
④NO2,Fe(OH)3,FeC12都能直接通过化合反应制备
⑤H2S能使酸性高锰酸钾溶液褪色.所以它具有漂白性.
| A. | ②③④ | B. | ①②③ | C. | ①②③④ | D. | ①②③⑤ |
2.下列物质性质与应用对应关系正确的是( )
| A. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| B. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| C. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |
18.常温下用石墨电极,电解100mL 0.1mol•L-1C u(NO3)2和0.1mol•L-1A gNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为1.12L时,假设溶液体积不变,下列说法正确的是( )
| A. | 阴极增重1.72g | B. | 所得溶液 pH<1 | C. | 阴极增重0.64g | D. | 所得溶液pH>1 |
 呵护生存环境,共建和谐社会是当今社会的主题.
呵护生存环境,共建和谐社会是当今社会的主题.