题目内容
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、18 g水中所含的电子数为10NA |
| B、1 mol氧中有2NA个氧原子 |
| C、0.3 mol?L-1Na2SO4溶液中含0.6NA个Na+ |
| D、11.2L氮气中含NA个氮原子 |
考点:阿伏加德罗常数
专题:
分析:A.质量换算物质的量,结合水分子是10电子微粒计算电子数;
B.没有指明具体的粒子名称,是1mol氧气还是1mol氧原子;
C.溶液体积不知无法计算微粒数;
D.温度压强不知体积无法换算物质的量.
B.没有指明具体的粒子名称,是1mol氧气还是1mol氧原子;
C.溶液体积不知无法计算微粒数;
D.温度压强不知体积无法换算物质的量.
解答:
解:A.18 g水物质的量为1mol,水分子是10电子微粒,所以1mol水分子中所含的电子数为10NA,故A正确;
B.使用物质的量时,必须指出具体的粒子名称,1mol氧没有说明是氧原子还是氧气分子,故B错误;
C.0.3 mol?L-1Na2SO4溶液中,溶液体积不知无法计算微粒数,故C错误;
D.温度压强不知,11.2L氮气,体积无法换算物质的量,故D错误.
故选A.
B.使用物质的量时,必须指出具体的粒子名称,1mol氧没有说明是氧原子还是氧气分子,故B错误;
C.0.3 mol?L-1Na2SO4溶液中,溶液体积不知无法计算微粒数,故C错误;
D.温度压强不知,11.2L氮气,体积无法换算物质的量,故D错误.
故选A.
点评:本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,质量换算物质的量计算微粒数,稀有气体是单原子分子是解题关键,题目难度不大.

练习册系列答案
相关题目
对于Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H=?的化学反应,下列叙述不正确的是( )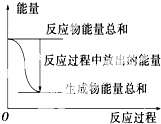

| A、反应过程中能量关系如上图表示,则该反应为放热反应 |
| B、若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C、化学反应的焓变与反应方程式的计量数有关 |
| D、若将该反应设计成原电池,锌为负极 |
在a L Fe2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;若加入足量强碱并加热可得到c mol NH3,则原溶液中Fe3+的浓度(mol?L-1)为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O含有的分子数为1 NA |
| B、常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,1 NA 个CO2分子占有的体积为22.4 L |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为1NA |
下列有关气体体积的叙述正确的是( )
| A、一定温度和压强下,各种气态物质的体积大小,由构成气体的分子大小决定的 |
| B、不同的气体,若体积不同,则他们的分子数也不同 |
| C、一定温度和压强下,各种气态物质的体积大小,由构成气体的分子数决定的 |
| D、气体摩尔体积是指1 mol任何气体所占的体积约为22.4L |