题目内容
对于Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H=?的化学反应,下列叙述不正确的是( )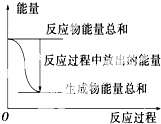

| A、反应过程中能量关系如上图表示,则该反应为放热反应 |
| B、若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C、化学反应的焓变与反应方程式的计量数有关 |
| D、若将该反应设计成原电池,锌为负极 |
考点:反应热和焓变,原电池和电解池的工作原理
专题:
分析:A、根据放热反应中反应物的总能量大于生成物的总能量;
B、根据总反应方程式以及气体的体积与状态有关来计算;
C、反应热△H的值与反应方程式的计量系数成正比;
D、原电池的负极失去电子.
B、根据总反应方程式以及气体的体积与状态有关来计算;
C、反应热△H的值与反应方程式的计量系数成正比;
D、原电池的负极失去电子.
解答:
解:A、由右图可以得出,反应物的总能量大于生成物的总能量,则该反应为放热反应,故A正确;
B、Zn+H2SO4 =ZnSO4 +H2↑
65g 22.4L
65g 11.2L
所以32.5g锌溶解时,正极放出气体在标况下11.2L,不一定为11.2L,故B错误;
C、反应热△H的值与反应方程式的计量系数成正比,故C正确;
D、Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)的反应中锌失去电子,化合价升高,作原电池的负极,故D正确;
故选:B.
B、Zn+H2SO4 =ZnSO4 +H2↑
65g 22.4L
65g 11.2L
所以32.5g锌溶解时,正极放出气体在标况下11.2L,不一定为11.2L,故B错误;
C、反应热△H的值与反应方程式的计量系数成正比,故C正确;
D、Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)的反应中锌失去电子,化合价升高,作原电池的负极,故D正确;
故选:B.
点评:本题主要考查原电池原理、化学反应中的能量以及化学计算等,难度不大,根据课本知识即可完成.

练习册系列答案
相关题目
对于常温下0.1mol?L-1氨水和0.1mol?L-1醋酸,下列说法正确的是( )
| A、0.1 mol?L-1氨水,溶液的pH<13 |
| B、0.1 mol?L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
| C、0.1 mol?L-1醋酸溶液中:c(H+)=c(CH3COO-) |
| D、0.1 mol?L-1醋酸与0.1 mol?L-1NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
下列叙述正确的是( )
| A、某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D、25℃时,若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
与100mL 0.1mol/L AlCl3溶液中Cl-离子浓度相同的是( )
| A、10 mL 1 mol/L FeCl3溶液 |
| B、50 mL 0.3 mol/L NaCl溶液 |
| C、10 mL 0.2 mol/L CaCl2溶液 |
| D、200 mL 0.1 mol/L NH4Cl溶液 |
电化学降解NO3-的原理如图所示.下列说法中不正确的是( )


| A、铅蓄电池的A极为正极,电极材料为PbO2 |
| B、铅蓄电池工作过程中负极质量增加 |
| C、该电解池的阴极反应为:2NO3-+6H2O+10e-=N2↑+12OH- |
| D、若电解过程中转移2moL电子,则交换膜两侧电解液的质量变化差(△m左-△m右)为10.4g |
下列反应属于氧化还原反应的是( )
| A、CaCO3+2HCl=CaCl2+CO2↑+H2O | ||||
| B、CaO+H2O=Ca(OH)2 | ||||
C、CaCO3
| ||||
| D、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
乙炔、苯和乙醛的混合物中w(C)=72%(w为质量分数),则w(O)是( )
| A、22% | B、19.6% |
| C、8.8% | D、4.4% |
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、18 g水中所含的电子数为10NA |
| B、1 mol氧中有2NA个氧原子 |
| C、0.3 mol?L-1Na2SO4溶液中含0.6NA个Na+ |
| D、11.2L氮气中含NA个氮原子 |
在25℃时,pH=1的溶液中,下列各组离子可以大量共存的是( )
| A、Na+、Ca2+、Cl-、HCO3- |
| B、Na+、Fe3+、Cl-、HCO3- |
| C、Fe2+、Fe3+、Cl-、NO3- |
| D、Fe2+、Mg2+、Cl-、SO42- |