题目内容
化学实验是研究物质性质的基础.
(1)下列有关实验操作或测量数据合理的是 (填序号).
a.用铁坩埚加热CuSO4?5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20mL的量筒,量取16.8mL的Na2CO3溶液
(2)某废水样品中含有一定的Na+、CO32-、SO32-,甲、乙两研究小组欲测定其中SO32-离子的浓度.
甲组方案:废水100mL
SO
固体
计算
试剂X从下列试剂中选择:
a.0.1mol?L-1KMnO4(H2SO4酸化)溶液b.0.5mol?L-1NaOH溶液c.新制氯水d.KI溶液
①加入的试剂X为 (填字母序号),生成SO42-主要的离子方程式为 .
②甲组方案中,第iii步的“系列操作”包含的操作名称各为 .
乙组方案:
i.用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
ii.精确量取20.00mL过滤后废水试样,选择使用紫色的0.1mol?L-1KMnO4(H2SO4酸化)溶液进行滴定:(有关反应为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O
iii.记录数据,计算.
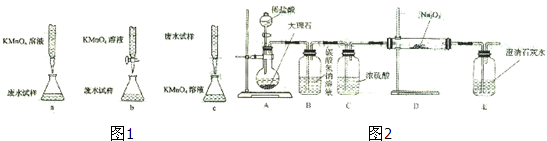
③乙组设计的下列滴定方式中,最合理的是(图1) (夹持部分略去)(填字母序号)
(3)某同学制备Fe(OH)3胶体:用洁净烧杯量 取适量蒸馏水加热至沸腾,向烧杯中缓慢滴加饱和的FeCl3溶液,并不断用玻璃棒搅拦,结果溶液变浑浊.该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是 .
(4)用图2装置进行CO2性质的有关实验.
①试剂瓶B中盛有饱和NaHCO3溶液,其目的是 .
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 .
(1)下列有关实验操作或测量数据合理的是
a.用铁坩埚加热CuSO4?5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20mL的量筒,量取16.8mL的Na2CO3溶液
(2)某废水样品中含有一定的Na+、CO32-、SO32-,甲、乙两研究小组欲测定其中SO32-离子的浓度.
甲组方案:废水100mL
| 试剂X |
2- 4 |
| Ⅰ加盐酸ⅡBaCl2溶液 |
| Ⅲ系列操作 |
| 称量 |
试剂X从下列试剂中选择:
a.0.1mol?L-1KMnO4(H2SO4酸化)溶液b.0.5mol?L-1NaOH溶液c.新制氯水d.KI溶液
①加入的试剂X为
②甲组方案中,第iii步的“系列操作”包含的操作名称各为
乙组方案:
i.用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
ii.精确量取20.00mL过滤后废水试样,选择使用紫色的0.1mol?L-1KMnO4(H2SO4酸化)溶液进行滴定:(有关反应为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O
iii.记录数据,计算.
③乙组设计的下列滴定方式中,最合理的是(图1)

(3)某同学制备Fe(OH)3胶体:用洁净烧杯量 取适量蒸馏水加热至沸腾,向烧杯中缓慢滴加饱和的FeCl3溶液,并不断用玻璃棒搅拦,结果溶液变浑浊.该同学制备胶体失败的原因是
(4)用图2装置进行CO2性质的有关实验.
①试剂瓶B中盛有饱和NaHCO3溶液,其目的是
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系
考点:探究物质的组成或测量物质的含量,中和滴定,性质实验方案的设计
专题:
分析:(1)a.铁会和CuSO4发生置换反应;
b.浓硫酸有脱水性,可以使pH试纸脱水碳化;
C.量筒精确到0.1;
(2)①亚硫酸根离子生成硫酸根离子需要氧化剂,所选试剂应具有氧化性;氯气有氧化性,亚硫酸根离子有还原性,所以亚硫酸根离子和氯气能发生氧化还原反应;
②由固、液混合溶液得纯净、干燥的沉淀的操作要经过滤、洗涤、干燥;
③酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,高锰酸钾滴定废水,溶液由无色变为有色,现象明显;
(3)搅拌能使胶体聚沉;将饱和的FeCl3溶液滴入沸水中,加热直到得到红褐色溶液;
(4)实验流程为A装置制取二氧化碳,B、C装置净化二氧化碳,D装置验证二氧化碳性质,E装置检验二氧化碳;
①根据实验目的来分析仪器B加入饱和的NaHCO3溶液的目的;
②根据沉淀溶解平衡的书写方法写出,注意固体及溶液的标注方法.
b.浓硫酸有脱水性,可以使pH试纸脱水碳化;
C.量筒精确到0.1;
(2)①亚硫酸根离子生成硫酸根离子需要氧化剂,所选试剂应具有氧化性;氯气有氧化性,亚硫酸根离子有还原性,所以亚硫酸根离子和氯气能发生氧化还原反应;
②由固、液混合溶液得纯净、干燥的沉淀的操作要经过滤、洗涤、干燥;
③酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,高锰酸钾滴定废水,溶液由无色变为有色,现象明显;
(3)搅拌能使胶体聚沉;将饱和的FeCl3溶液滴入沸水中,加热直到得到红褐色溶液;
(4)实验流程为A装置制取二氧化碳,B、C装置净化二氧化碳,D装置验证二氧化碳性质,E装置检验二氧化碳;
①根据实验目的来分析仪器B加入饱和的NaHCO3溶液的目的;
②根据沉淀溶解平衡的书写方法写出,注意固体及溶液的标注方法.
解答:
解:(1)a.用铁坩埚加热CuSO4?5H2O,铁会和CuSO4发生置换反应,造成误差,故a错误;
b.不能用干燥的pH试纸测定浓硫酸的pH,浓硫酸有脱水性,可以使pH试纸脱水碳化,不能与标准比色卡比较,故b错误;
C.量筒精确到0.1,可量取16.8mL的Na2CO3溶液,故c正确;
故答案为:c;
(2)①亚硫酸根离子有还原性,能被强氧化剂氧化成硫酸根离子,所以要想使亚硫酸根离子生成硫酸根离子,应选择氧化性物质;
a.虽然酸性高锰酸钾有强氧化性,但有硫酸根离子造成干扰,故A错误;
b.氢氧化钠没有氧化性,故B错误;
c.氯水有强氧化性,且不造成干扰,故C正确;
d.碘化钾有还原性没有氧化性,故D错误;
氯气有氧化性,亚硫酸根离子有还原性,所以亚硫酸根离子和氯气能发生氧化还原反应生成氯离子、硫酸根离子和氢离子Cl2+SO32-+H2O=2Cl-+SO42-+2 H+;
故答案为:c;Cl2+SO32-+H2O=2Cl-+SO42-+2 H+;
②由固、液混合溶液得纯净、干燥的沉淀的操作要经过滤、洗涤、干燥,故答案为:过滤、洗涤、干燥;
③酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,溶液由无色变为有色,现象明显,应用高锰酸钾滴定废水,
故答案为:b;
(3)制备Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,加热直到得到红褐色溶液,不能搅拌,
故答案为:搅拌导致胶体聚沉;液体呈透明的红褐色;
(4)①根据实验目的来分析,反应生成的二氧化碳中含有氯化氢和水蒸气杂质气体,仪器B加入饱和的NaHCO3溶液的目的除去二氧化碳中的HCl气体;
故答案为:除去二氧化碳中的HCl气体;
②将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,得到碳酸钙沉淀,碳酸钙的溶解平衡为CaCO3(s)?Ca2+(aq)+CO32-(aq),
故答案为:CaCO3(s)?Ca2+(aq)+CO32-(aq).
b.不能用干燥的pH试纸测定浓硫酸的pH,浓硫酸有脱水性,可以使pH试纸脱水碳化,不能与标准比色卡比较,故b错误;
C.量筒精确到0.1,可量取16.8mL的Na2CO3溶液,故c正确;
故答案为:c;
(2)①亚硫酸根离子有还原性,能被强氧化剂氧化成硫酸根离子,所以要想使亚硫酸根离子生成硫酸根离子,应选择氧化性物质;
a.虽然酸性高锰酸钾有强氧化性,但有硫酸根离子造成干扰,故A错误;
b.氢氧化钠没有氧化性,故B错误;
c.氯水有强氧化性,且不造成干扰,故C正确;
d.碘化钾有还原性没有氧化性,故D错误;
氯气有氧化性,亚硫酸根离子有还原性,所以亚硫酸根离子和氯气能发生氧化还原反应生成氯离子、硫酸根离子和氢离子Cl2+SO32-+H2O=2Cl-+SO42-+2 H+;
故答案为:c;Cl2+SO32-+H2O=2Cl-+SO42-+2 H+;
②由固、液混合溶液得纯净、干燥的沉淀的操作要经过滤、洗涤、干燥,故答案为:过滤、洗涤、干燥;
③酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,溶液由无色变为有色,现象明显,应用高锰酸钾滴定废水,
故答案为:b;
(3)制备Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,加热直到得到红褐色溶液,不能搅拌,
故答案为:搅拌导致胶体聚沉;液体呈透明的红褐色;
(4)①根据实验目的来分析,反应生成的二氧化碳中含有氯化氢和水蒸气杂质气体,仪器B加入饱和的NaHCO3溶液的目的除去二氧化碳中的HCl气体;
故答案为:除去二氧化碳中的HCl气体;
②将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,得到碳酸钙沉淀,碳酸钙的溶解平衡为CaCO3(s)?Ca2+(aq)+CO32-(aq),
故答案为:CaCO3(s)?Ca2+(aq)+CO32-(aq).
点评:本题考查化学实验方案的评价及性质实验方案的设计,侧重于学生的分析能力和实验能力的考查,注意相关知识的学习与积累,题目难度中等.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
与100mL 0.1mol/L AlCl3溶液中Cl-离子浓度相同的是( )
| A、10 mL 1 mol/L FeCl3溶液 |
| B、50 mL 0.3 mol/L NaCl溶液 |
| C、10 mL 0.2 mol/L CaCl2溶液 |
| D、200 mL 0.1 mol/L NH4Cl溶液 |
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、18 g水中所含的电子数为10NA |
| B、1 mol氧中有2NA个氧原子 |
| C、0.3 mol?L-1Na2SO4溶液中含0.6NA个Na+ |
| D、11.2L氮气中含NA个氮原子 |
下列离子方程式不正确的是( )
A、Cu和浓硫酸在加热条件下的反应:Cu+2H2SO4(浓)
| ||||
| B、含氟牙膏防治龋齿的化学原理:Ca5(PO4)3OH+F-?Ca5(PO4)3F+OH- | ||||
| C、用0.100mol?L-1的NaHSO4标准溶液滴定Ba(OH)2溶液,用酚酞做指示剂,接近滴定终点时的离子反应:H++OH-═H2O | ||||
| D、次磷酸(H3PO2)为一元中强酸,与NaOH溶液反应:H3PO2+OH-═H2PO2-+H2O |
Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )
| A、Na2CO3是碳酸盐 |
| B、Na2CO3是正盐 |
| C、Na2CO3是钠盐 |
| D、Na2CO3是碱 |
在25℃时,pH=1的溶液中,下列各组离子可以大量共存的是( )
| A、Na+、Ca2+、Cl-、HCO3- |
| B、Na+、Fe3+、Cl-、HCO3- |
| C、Fe2+、Fe3+、Cl-、NO3- |
| D、Fe2+、Mg2+、Cl-、SO42- |
 同分异构体A1和A2分别与浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的52倍,含碳的质量分数为92.3%.在催化剂存在下,1mol B可以和4mol H2发生加成反应.核磁共振氢谱显示,H有5个吸收峰.有关物质之间的转化关系如下:
同分异构体A1和A2分别与浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的52倍,含碳的质量分数为92.3%.在催化剂存在下,1mol B可以和4mol H2发生加成反应.核磁共振氢谱显示,H有5个吸收峰.有关物质之间的转化关系如下: