题目内容
11.下列关于元素周期律的说法中错误的是( )| A. | 氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 | |
| B. | 离子的还原性:S2->Cl->Br->I- | |
| C. | 酸性:H2SO4>H3PO4>H2CO3>HClO | |
| D. | 金属性:Be<Mg<Ca<K |
分析 A.元素的非金属性越强,其氢化物的稳定性越强;
B.元素的非金属性越弱,其简单阴离子的还原性越强;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,同一种元素含氧酸,非羟基O原子个数越多其酸性越强;
D.同一周期元素金属性随着原子序数增大而减弱,同一主族元素其金属性随着原子序数增大而增强.
解答 解:A.元素的非金属性越强,其对应的氢化物越稳定,所以氢化物的稳定性大小顺序为:HF>HCl>H2S>PH3>SiH4,故A正确;
B.元素的非金属性越弱,其简单阴离子的还原性越强,所以还原性顺序应该是:S2->I->Br->Cl-,故B错误;
C.元素的非金属性越强,其对应的最高价含氧酸的酸性越强,同一种元素含氧酸,非羟基O原子个数越多其酸性越强,次氯酸酸性最弱,所以酸性强弱顺序是H2SO4>H3PO4>H2CO3>HClO,故C正确;
D.同一周期元素金属性随着原子序数增大而减弱,同一主族元素其金属性随着原子序数增大而增强,所以金属性:Be<Mg<Ca<K,故D正确;
故选B.
点评 本题考查氢化物的稳定性比较方法、离子的还原性的比较、最高价含氧酸的酸性比较等元素周期律知识,侧重考查学生对元素周期律的理解和运用,明确元素周期律规律是解本题关键,易错选项是C,注意次氯酸酸性很弱但具有强氧化性.

练习册系列答案
相关题目
1.下列有关氧化还原反应的叙述中正确的是( )
| A. | 有单质参加或有单质生成的反应一定是氧化还原反应 | |
| B. | 氧化还原的本质是元素化合价的升降 | |
| C. | 失电子越多,该物质的还原性就越强 | |
| D. | 金属单质在化学反应中一定作还原剂 |
19.已知:
①CH4(g)+4N02(g)═4NO(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4N0(g)═2N2(g)+CO2+2H2O(g)△H2=-1160KJ•mol-1
则CH4催化还原NOX的相关说法正确的是( )
①CH4(g)+4N02(g)═4NO(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4N0(g)═2N2(g)+CO2+2H2O(g)△H2=-1160KJ•mol-1
则CH4催化还原NOX的相关说法正确的是( )
| A. | 由①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(1)的△H大于△H1 | |
| B. | 等物质的量的甲烷分别发生①②反应至完全,转移的电子数不同 | |
| C. | 若用0.2 mol CH4发生上述反应还原足量的NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 LCH4还原足量的NO2至N2,整个过程中转移的电子的物质的量为16 mol |
20.下列物质属于纯净物的是( )
| A. | 碘酒 | B. | 漂白粉 | C. | 食盐水 | D. | 液氯 |
1.下列分离与提纯的方法正确的是( )
| A. | 除去Mg粉中混有的Al粉:加入足量的氨水,过滤 | |
| B. | 除去BaCO3固体中混有的BaSO4:加入过量盐酸后,过滤、洗涤 | |
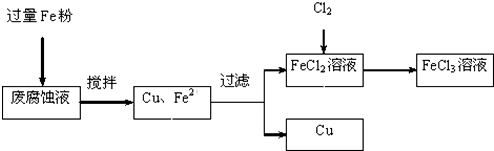
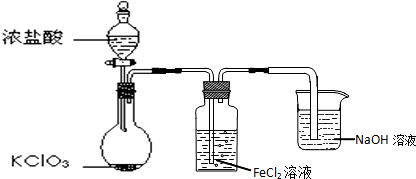
| C. | 除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 | |
| D. | 从I2的四氯化碳溶液中分离出I2:分液 |




 营养平衡、合理用药是保证人体健康和生活质量的重要途径.
营养平衡、合理用药是保证人体健康和生活质量的重要途径.