题目内容
1.下列有关氧化还原反应的叙述中正确的是( )| A. | 有单质参加或有单质生成的反应一定是氧化还原反应 | |
| B. | 氧化还原的本质是元素化合价的升降 | |
| C. | 失电子越多,该物质的还原性就越强 | |
| D. | 金属单质在化学反应中一定作还原剂 |
分析 A.同素异形体的转化中没有元素的化合价变化;
B.氧化还原反应的本质为电子的转移;
C.还原性与失去电子多少无关;
D.金属单质在反应中只能失去电子.
解答 解:A.同素异形体的转化中,有单质参加也有单质生成,没有元素的化合价变化,不属于氧化还原反应,故A错误;
B.氧化还原反应的本质为电子的转移,其特征为化合价的升降,故B错误;
C.还原性与失去电子多少无关,与失去电子的难易程度有关,故C错误;
D.金属单质在反应中只能失去电子,则只作还原剂,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
9.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知2C(s)+2O2(g)═2CO2 (g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 | |
| D. | 已知Ni(CO)4(s)═Ni(s)+4CO(g)△H=Q kJ•mol-1,则Ni(s)+4CO(g)═Ni(CO)4(s)△H=-QkJ•mol-1 |
16.为了实现下列各变化,必须加入还原剂的是( )
| A. | H2O2→H2O | B. | NH4+→NH3 | C. | Fe3+→Fe2+ | D. | CO→CO2 |
6.将20.8g Cu和CuO的混合物加入到1L混有H2SO4的Fe2(SO4)3溶液中,样品完全溶解时,溶液中Fe3+、Fe2+、H+的物质的量之比为1:4:1(不考虑溶液体积的变化).若测得反应后溶液中的c(H+)=0.1mol•L-1,则下列说法中错误的是( )
| A. | 原混合物中Cu为12.8g | B. | 原溶液中c(SO42-)=0.15mol•L-1 | ||
| C. | 反应后溶液中Cu2+为0.3mol | D. | 反应后溶液中c(SO42-)为0.8mol•L-1 |
13.某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如图所示.
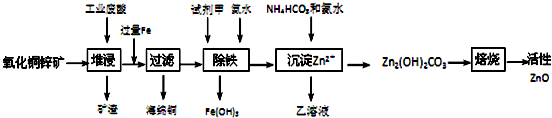
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示.
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)< Ksp(ZnS)(选填“>”“<”或“=”).
(2)你认为在除铁过程中选用下列物质中的C(填序号)作为试剂甲是比较合适的.
A.KMnO4 B.HNO3 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)请写出加甲物质后,加入氨水控制调节溶液的pH生成Fe(OH)3反应的离子方程式Fe3++3NH3•H2O═Fe﹙OH)3↓+3NH4+.
(5)298K时残留在乙溶液中的c(Fe3+)在2.7×10-15.6 mol/L以下(Fe(OH)3的KSP=2.70×10-39)
(6)乙的溶液可直接用作氮肥,则乙的化学式是(NH4)2SO4.
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式2ZnSO4+NH4HCO3+3NH3.H2O═Zn2(OH)2CO3↓+2(NH4)2SO4+H2O.

已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)< Ksp(ZnS)(选填“>”“<”或“=”).
(2)你认为在除铁过程中选用下列物质中的C(填序号)作为试剂甲是比较合适的.
A.KMnO4 B.HNO3 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)请写出加甲物质后,加入氨水控制调节溶液的pH生成Fe(OH)3反应的离子方程式Fe3++3NH3•H2O═Fe﹙OH)3↓+3NH4+.
(5)298K时残留在乙溶液中的c(Fe3+)在2.7×10-15.6 mol/L以下(Fe(OH)3的KSP=2.70×10-39)
(6)乙的溶液可直接用作氮肥,则乙的化学式是(NH4)2SO4.
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式2ZnSO4+NH4HCO3+3NH3.H2O═Zn2(OH)2CO3↓+2(NH4)2SO4+H2O.
11.下列关于元素周期律的说法中错误的是( )
| A. | 氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 | |
| B. | 离子的还原性:S2->Cl->Br->I- | |
| C. | 酸性:H2SO4>H3PO4>H2CO3>HClO | |
| D. | 金属性:Be<Mg<Ca<K |