题目内容
1.下列分离与提纯的方法正确的是( )| A. | 除去Mg粉中混有的Al粉:加入足量的氨水,过滤 | |
| B. | 除去BaCO3固体中混有的BaSO4:加入过量盐酸后,过滤、洗涤 | |
| C. | 除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 | |
| D. | 从I2的四氯化碳溶液中分离出I2:分液 |
分析 A.Al能溶于强碱但不溶于弱碱,Mg和强碱、弱碱溶液都不反应;
B.硫酸钡不溶于稀盐酸,但碳酸钡能溶于稀盐酸;
C.Fe和FeCl3反应生成FeCl2;
D.互溶的物质不能采用分液方法分离.
解答 解:A.Al能溶于强碱但不溶于弱碱,Mg和强碱、弱碱溶液都不反应,Al和氨水不反应,所以不能用氨水作除杂剂,应该选取强碱溶液,然后采用过滤方法分离,故A错误;
B.硫酸钡不溶于稀盐酸,但碳酸钡能溶于稀盐酸,所以不能用稀盐酸除去碳酸钡中的硫酸钡,故B错误;
C.Fe和FeCl3反应生成FeCl2且不引进新的杂质,然后过滤即可得到纯净的氯化亚铁溶液,故C正确;
D.互溶的物质不能采用分液方法分离,碘极易溶于四氯化碳,所以不能采用分液方法分离,应该采用蒸馏方法分离,故D错误;
故选C.
点评 本题考查物质分离和提纯及基本操作方法,为高频考点,明确物质性质差异性是解本题关键,难点是除杂剂的选取,除杂时不能引进新的杂质且操作简单易行,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
11.下列关于元素周期律的说法中错误的是( )
| A. | 氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 | |
| B. | 离子的还原性:S2->Cl->Br->I- | |
| C. | 酸性:H2SO4>H3PO4>H2CO3>HClO | |
| D. | 金属性:Be<Mg<Ca<K |
12.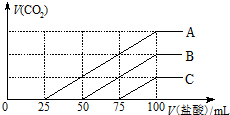 浓度相同的NaOH溶液各100ml 倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐渐加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100ml 倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐渐加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示.下列判断正确的是( )
 浓度相同的NaOH溶液各100ml 倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐渐加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100ml 倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐渐加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示.下列判断正确的是( )| A. | 原NaOH溶液的浓度为0.2mol/L | |
| B. | B烧杯中通入CO2体积为448ml | |
| C. | 通入CO2后,不能确定A烧杯中的溶质 | |
| D. | 通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=2:1 |
6.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 在常温常压下,11.2 L Cl2含有的分子数为0.5NA | |
| B. | 在常温常压下,17 g NH3所含的原子数为4NA | |
| C. | 标准状况下,11.2 L CCl4所含的分子数为0.5NA | |
| D. | 56g金属铁与足量的氯气反应时,失去的电子数为2NA |
13.在实验室,下列试剂不需保存在棕色试剂瓶内的是( )
| A. | 浓硝酸 | B. | 新制溴水 | C. | 浓盐酸 | D. | 硝酸银溶液 |
10.下列溶液中c(Cl-)与50mL1mol•L-1的AlCl3溶液中c(Cl-)相等的是( )
| A. | 150mL1mol•L-1NaCl溶液 | B. | 75mL2mol•L-1CaCl2溶液 | ||
| C. | 150mL3mol•L-1KCl溶液 | D. | 75mL3mol•L-1FeCl3溶液 |
18. 氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的是( )
氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的是( )
 氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的是( )
氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的是( )| A. | 相对分子质量 | B. | 稳定性 | C. | 沸点 | D. | R-H键长 |
 硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答: