题目内容
4.从宏观现象探究微观本质是重要的化学学科素养.以FeCl3溶液为实验研究对象,探究其与碱性物质之间的复杂多样性.实验如图:

(1)①中反应的离子方程式是3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+.
(2)②中逸出的无色气体是CO2.
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
Ⅰ.甲取③中的红棕色溶液少许,滴入少量盐酸酸化的BaCl2溶液,产生白色沉淀. 甲得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是2Fe3++SO32-+H2O=2Fe2++SO42-+2H+.
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的.其实验方案是取Ⅰ中所得溶液少许进行亚铁离子(或Fe2+)离子的检验.
(4)受以上实验的启发,同学们对pH≈8的1mol/LNaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
| 实验操作及现象 | ④向2mL0.2mol/L FeCl3溶液中滴入2mL1mol/LNaF溶液.溶液变无色 |
| ⑤向2mL0.2mol/L FeCl3溶液中滴入2mL蒸馏水,溶液颜色变浅 |
Ⅱ.为探究④中溶液变无色的原因,进行如下实验:
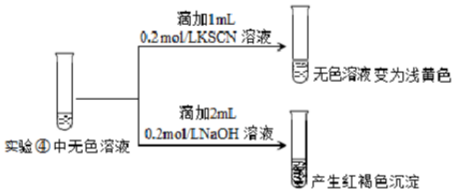
资料显示:FeF3溶液为无色.
用平衡移动原理解释红褐色沉淀产生的原因:无色溶液中存在平衡:Fe3++3F-?FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3.
(5)根据实验,FeCl3溶液与碱性物质之间的反应的多样性与碱性物质的pH、离子的性质有关.
分析 (1)①中产生红褐色胶体,说明生成氢氧化铁胶体,据此书写;
(2)由FeCl3和Na2CO3的性质可知逸出的无色气体是CO2;
(3)Ⅰ三价铁离子具有氧化性,能氧化SO32-,生成硫酸根离子,同时三价铁离子被还原为亚铁离子;
Ⅱ还需要对亚铁离子(或Fe2+)的检验;
(4)Ⅰ排除加水稀释对溶液颜色变化的影响;
Ⅱ无色溶液中存在平衡:Fe3++3F-?FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3;
(5)FeCl3溶液与碱性物质之间的反应的多样性与碱性物质的pH、阴、阳离子的性质和反应条件有关.
解答 解:(1)①中反应的离子方程式:3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+;
故答案为:3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+;
(2)FeCl3溶液和Na2CO3溶液反应产生无色气体CO2和红褐色沉淀氢氧化铁;
故答案为:CO2;
(3)Ⅰ.三价铁离子能氧化SO32-,生成硫酸根离子,同时三价铁离子被还原为亚铁离子,其反应离子方程式为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;
故答案为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的.其实验方案是取Ⅰ中所得溶液少许进行亚铁离子(或Fe2+)的检验;
故答案为:亚铁离子(或Fe2+);
(4)Ⅰ.加水稀释对溶液颜色变化有影响;
故答案为:排除加水稀释对溶液颜色变化的影响;
Ⅱ.无色溶液中存在平衡:Fe3++3F-?FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3;
故答案为:无色溶液中存在平衡:Fe3++3F-?FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3;
(5)根据实验,FeCl3溶液与碱性物质之间的反应的多样性与碱性物质的pH、离子的性质有关;
故答案为:碱性物质的pH、离子的性质.
点评 本题考查了探究反应机理的方法,铁的重要化合物性质、电离方程式、离子方程式的书写,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.

| A. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、H+和H2是氢元素的四种不同粒子 | |
| B. | ${\;}_{20}^{40}$Ca和${\;}_{20}^{42}$Ca、石墨和金刚石均互为同素异形体 | |
| C. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H是不同的核素 | |
| D. | 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 |
| A. | Na2CO3和HCl | B. | NaCl和Na2CO3 | C. | H2SO4和BaCl2 | D. | NaCl和Na2SO4 |
 某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.
某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.