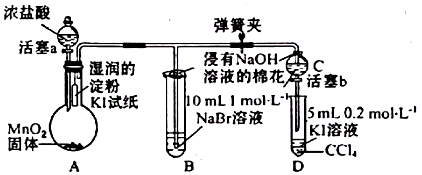
题目内容
4.某同学做同周期元素性质递交规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应;再向反应液中滴加酚酞 | 产生气体,气体可燃,溶液变浅红色 |
| ②向新制得Na2S饱和溶液中滴加新制氯水 | 生成淡黄色沉淀 |
| ③钠与滴有酚酞试液的冷水反应 | 浮于水面上,熔成小球,四处游动,逐渐缩小,溶液变红色 |
| ④镁带与2mol/L的盐酸反应 | 剧烈反应,产生的气体可燃 |
| ⑤铝条与2mol/L的盐酸反应 | 反应不十分剧烈;产生的气体可燃 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | 先生成白色絮状沉淀,最后沉淀全部溶解 |
| 实验方案 | 实验现象 | 有关离子方程式 |
| ① | 不填 | 不填 |
| ② | S2-+Cl2=S↓+2Cl- | |
| ③ | 不填 | 2Na+2H2O=2Na++2OH-+H2↑ |
| ④ | 不填 | 不填 |
| ⑤ | 不填 | 2Al+6H+=2Al3++3H2↑ |
| ⑥ | 先生成白色絮状沉淀,最后沉淀全部溶解 | Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O |
(2)实验用品:略.
(3)实验内容:(填写题给信息表中相应的实验现象,并在有空格处写出相对应的离子方程式)
(4)实验结论:同周期元素随原子序数的增大,元素的金属性逐渐减弱,而非金属性逐渐增强.
(5)问题与讨论:
请从原子结构理论上简单说明具有上述结论的原因是同周期元素随核电荷数的增加,原子核对核外电子的束缚力增强,原子半径减小,原子失电子能力减弱,而得到电子能力增强,即元素金属性逐渐减弱,二非金属性逐渐增强.
分析 ①用砂纸打磨后的镁带与沸水反应;再向反应液中滴加酚酞,产生气体,气体可燃,溶液变浅红色,是镁和水反应生成氢氧化镁和氢气;
②向新制得Na2S饱和溶液中滴加新制氯水,溶液中出现淡黄色沉淀硫单质,氯气氧化硫化钠生成;
③钠与滴有酚酞试液的冷水反应,浮于水面上,熔成小球,四处游动,逐渐缩小,溶液变红色,钠和水剧烈反应生成氢氧化钠和氢气;
④镁带与2mol/L的盐酸反应,剧烈反应,产生的气体可燃为氢气,生成氯化镁和氢气;
⑤铝条与2mol/L的盐酸反应,反应不十分剧烈;产生的气体可燃为氢气,生成氯化铝和氢气;
⑥向AlCl3溶液中滴加NaOH溶液至过量,先生成氢氧化铝沉淀,滴入氢氧化钠沉淀溶解至消失.
解答 解:(3)①用砂纸打磨后的镁带与沸水反应;再向反应液中滴加酚酞,产生气体,气体可燃,溶液变浅红色,是镁和水反应生成氢氧化镁和氢气;
②向新制得Na2S饱和溶液中滴加新制氯水,溶液中出现淡黄色沉淀硫单质,氯气氧化硫化钠生成;
③钠与滴有酚酞试液的冷水反应,浮于水面上,熔成小球,四处游动,逐渐缩小,溶液变红色,钠和水剧烈反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;
④镁带与2mol/L的盐酸反应,剧烈反应,产生的气体可燃为氢气,生成氯化镁和氢气;
⑤铝条与2mol/L的盐酸反应,反应不十分剧烈;产生的气体可燃为氢气,生成氯化铝和氢气,反应的离子方程式为:2Al+6H+=2Al3++3H2↑;
⑥向AlCl3溶液中滴加NaOH溶液至过量,先生成氢氧化铝沉淀,滴入氢氧化钠沉淀溶解至消失;
故答案为:
| 实验方案 | 实验现象 | 有关离子方程式 |
| ① | 不填 | 不填 |
| ② | 生成淡黄色沉淀 | S2-+Cl2=S↓+2Cl- |
| ③ | 不填 | 2Na+2H2O=2Na++2OH-+H2↑ |
| ④ | 不填 | 不填 |
| ⑤ | 不填 | 2Al+6H+=2Al3++3H2↑ |
| ⑥ | 先生成白色絮状沉淀,最后沉淀全部溶解 | Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O |
故答案为:同周期元素随原子序数的增大,元素的金属性逐渐减弱,而非金属性逐渐增强;
(5)从原子结构理论上分析可知,同周期元素随核电荷数的增加,原子核对核外电子的束缚力增强,原子半径减小,原子失电子能力减弱,而得到电子能力增强,即元素金属性逐渐减弱,而非金属性逐渐增强,
故答案为:同周期元素随核电荷数的增加,原子核对核外电子的束缚力增强,原子半径减小,原子失电子能力减弱,而得到电子能力增强,即元素金属性逐渐减弱,而非金属性逐渐增强.
点评 本题考查了元素性质递变规律的分析、主要是同周期元素性质递变规律的实验验证,反应现象不同和反应实质是解题关键,题目难度中等.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
14.某有机物的结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该物质的分子式为C11H10O3 | |
| B. | 该有机物含有4种官能团 | |
| C. | 1 mol该有机物最多可以消耗2 mol NaOH | |
| D. | 该有机物不能发生消去反应 |
12.含有元素硒(Se)的保健品已开始进入市场.已知它与氧同族,与钾同周期.则下列关于硒的叙述中,正确的是( )
| A. | 金属性比钾强 | B. | 最高价氧化物的化学式是SeO3 | ||
| C. | 高价含氧酸的酸性:H2SeO4>H2SO4 | D. | 氢化物稳定性:H2Se>H2O |
9.根据图,下列判断中正确的是( )
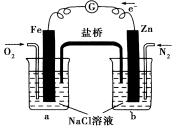

| A. | 烧杯b中发生还原反应 | |
| B. | 烧杯b中发生的反应为2Cl--2e-═Cl2↑ | |
| C. | 烧杯a中发生的反应为2H++2e-═H2↑ | |
| D. | 烧杯a中的溶液pH升高 |
8.同主族元素形成的同一类型化合物,往往其结构和性质相似.PH4I 是一种白色晶体,下 列对 PH4I 的叙述中,正确的是( )
| A. | 它是一种共价化合物 | B. | 它受热时,不能分解产生有色气体 | ||
| C. | 它不可能与 NaOH 溶液反应 | D. | 它既含离子键又含共价键 |
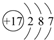 .
.