题目内容
14.某有机物的结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该物质的分子式为C11H10O3 | |
| B. | 该有机物含有4种官能团 | |
| C. | 1 mol该有机物最多可以消耗2 mol NaOH | |
| D. | 该有机物不能发生消去反应 |
分析 有机物含有碳碳双键、羟基、羧基,结合烯烃、羧酸以及醇的性质解答该题.
解答 解:A.由结构简式可知分子式为C11H12O3,故A错误;
B.含有碳碳双键、羟基、羧基3种官能团,故B错误;
C.能与氢氧化钠反应的只有羧基,则1 mol该有机物最多可以消耗1 mol NaOH,故C错误;
D.羟基邻位碳原子不含H,不能发生消去反应,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、酸、醇性质的考查,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
4.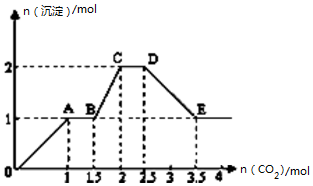 现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )
 现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )| A. | 该溶液中能确定存在的离子是 Ba2+、AlO2-、NH4+ | |
| B. | 肯定不存在的离子是SO42-、OH- | |
| C. | 若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为0.2mol/L | |
| D. | OA 段反应的离子方程式:2 AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
5.下列装置图对应的实验方案能达到实验目的是( )
| A. | 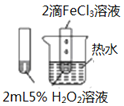 图验证FeCl3对H2O2分解反应有催化作用 | |
| B. | 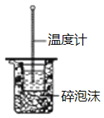 图用于中和热的测定 | |
| C. | 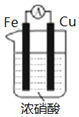 图用于探究Cu作负极的原电池原理 | |
| D. |  图用于比较盐酸、碳酸、硅酸的酸性 |
9.乙酸乙酯和丁酸互为同分异构体,下列方法中不能对二者进行鉴别的是( )
| A. | 利用金属钠 | B. | 利用质谱法 | ||
| C. | 利用红外光谱法 | D. | 利用核磁共振氢谱 |
19.下列操作或装置能达到实验目的是( )
| A. | 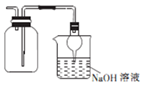 收集NO2并防止其污染环境 | |
| B. | 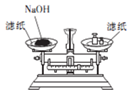 称取一定量的NaOH | |
| C. | 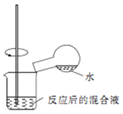 检验浓硫酸与铜反应后的产物中,是否含有铜离子 | |
| D. | 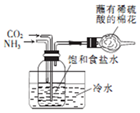 制取NaHCO3 |
6.设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 标准状况下,22.4 LH2O中含有极性键的数目为2NA | |
| B. | 78 g Na2O2中含有的阴离子数为NA | |
| C. | 11 g重水(D218O)中含有的电子数力5NA | |
| D. | 常温常压下,5.6 g铁粉在7.1 g氯气中充分燃烧,转移的电子数为0.2NA |
3.氢化钠(NaH)是一种白色的离子化合物,其中钠元素是+1价;氢化钠与水反应放出H2.下列叙述中,正确的是( )
| A. | NaH在水中显碱性 | |
| B. | NaH中氢元素的离子的电子层排布与氖原子的电子层排布相同 | |
| C. | 微粒半径H-<Li+ | |
| D. | NaH与H2O反应时,水作还原剂 |
4.某同学做同周期元素性质递交规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
请你帮助该同学整理并完成实验报告
(1)实验目的:验证同周期元素金属性、非金属性的变化规律.
(2)实验用品:略.
(3)实验内容:(填写题给信息表中相应的实验现象,并在有空格处写出相对应的离子方程式)
(4)实验结论:同周期元素随原子序数的增大,元素的金属性逐渐减弱,而非金属性逐渐增强.
(5)问题与讨论:
请从原子结构理论上简单说明具有上述结论的原因是同周期元素随核电荷数的增加,原子核对核外电子的束缚力增强,原子半径减小,原子失电子能力减弱,而得到电子能力增强,即元素金属性逐渐减弱,二非金属性逐渐增强.
| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应;再向反应液中滴加酚酞 | 产生气体,气体可燃,溶液变浅红色 |
| ②向新制得Na2S饱和溶液中滴加新制氯水 | 生成淡黄色沉淀 |
| ③钠与滴有酚酞试液的冷水反应 | 浮于水面上,熔成小球,四处游动,逐渐缩小,溶液变红色 |
| ④镁带与2mol/L的盐酸反应 | 剧烈反应,产生的气体可燃 |
| ⑤铝条与2mol/L的盐酸反应 | 反应不十分剧烈;产生的气体可燃 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | 先生成白色絮状沉淀,最后沉淀全部溶解 |
| 实验方案 | 实验现象 | 有关离子方程式 |
| ① | 不填 | 不填 |
| ② | S2-+Cl2=S↓+2Cl- | |
| ③ | 不填 | 2Na+2H2O=2Na++2OH-+H2↑ |
| ④ | 不填 | 不填 |
| ⑤ | 不填 | 2Al+6H+=2Al3++3H2↑ |
| ⑥ | 先生成白色絮状沉淀,最后沉淀全部溶解 | Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O |
(2)实验用品:略.
(3)实验内容:(填写题给信息表中相应的实验现象,并在有空格处写出相对应的离子方程式)
(4)实验结论:同周期元素随原子序数的增大,元素的金属性逐渐减弱,而非金属性逐渐增强.
(5)问题与讨论:
请从原子结构理论上简单说明具有上述结论的原因是同周期元素随核电荷数的增加,原子核对核外电子的束缚力增强,原子半径减小,原子失电子能力减弱,而得到电子能力增强,即元素金属性逐渐减弱,二非金属性逐渐增强.