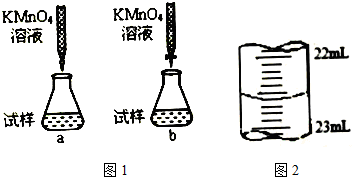
题目内容
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1.8g H218O中含有的中子数为NA | |
| B. | 1mol Fe与足量的浓硫酸反应,生成SO2的分子数为NA | |
| C. | 7.1g Cl2溶于水所得溶液中含有的Cl-数目为0.1NA | |
| D. | 丙烷燃料电池负极消耗2.24L(标准状况)气体时,电路中转移电子数为2NA |
分析 A、求出H218O的物质的量,然后根据1molH218O中含10mol中子来分析;
B、铁在浓硫酸中钝化;
C、氯气和水的反应为可逆反应;
D、负极上丙烷放电,碳元素的价态由-$\frac{8}{3}$变为+4价.
解答 解:A、1.8gH218O的物质的量为0.09mol,而1molH218O中含10mol中子,故0.09mol中含0.9NA个中子,故A错误;
B、铁在浓硫酸中钝化,故不能反应完全,则生成的二氧化硫分子个数小于NA个,故B错误;
C、氯气和水的反应为可逆反应,不能反应彻底,则溶液中含有的氯离子的个数小于0.1NA个,故C错误;
D、负极上丙烷放电,碳元素的价态由-$\frac{8}{3}$变为+4价,故标况下2.24L丙烷即0.1mol丙烷燃烧时,转移的电子数为0.3×(4+$\frac{8}{3}$)mol即2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
16.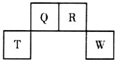 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )| A. | Q与W的原子能形成非极性分子 | |
| B. | T的离子半径大于W的离子半径 | |
| C. | RHn在同族元素的气态氢化物中沸点最低 | |
| D. | 在R的最高价氧化物对应水化物的浓溶液中单质T不溶解,说明未发生化学反应 |
3.下表中各栏目的叙述对应都正确的一项是( )
| 选项 | 叙述 | 实验现象 | 解释 |
| A | 反萃取法提取碘的CCl4溶液中的碘 | 向富碘的CCl4溶液中加入足量水、振荡、静置、分液 | 碘在水中溶解度比在CCl4中大 |
| B | 在FeCl3溶液中加入适量Fe粉充分反应后,再滴加几滴黄色铁氰化钾溶液 | 产生蓝色沉淀 | 2Fe3++Fe═3Fe2+ 3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ |
| C | 向0.1mol/L的Fe(NO3)2溶液中滴加盐酸 | 振荡试管颜色加深 | H+抑制Fe2+水解 |
| D | 让蛋白质从水溶液中析出 | 将CuSO4溶液加入蛋白质中发生盐析 | 重金属无机盐溶液可降低蛋白质的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
17.刘禹锡的“千淘万漉虽辛苦,吹尽狂砂始到金”,这首诗句反映了对淘金过程的描写,下列说法中正确的是( )
| A. | “千淘万漉”的基本原理是化学中的萃取 | |
| B. | 24K金(纯金)的各方面物理性能都比18K金优越 | |
| C. | 在铜件外镀金,金镀层破损了,会加快铜件的腐蚀速率 | |
| D. | 常温下,金不易被氧化,不与其它任何物质发生化学反应 |
14.在炼铜的过程中发生:Cu2S+2Cu2O═6Cu+SO2↑,则下列叙述正确的是( )
| A. | 该反应从电子转移角度看,与SO2+H2O═H2SO3是同一反应类型 | |
| B. | 该反应从电子转移角度看,每生成6mol铜,转移电子12mol | |
| C. | 该反应中,Cu2S既是还原剂又是氧化剂 | |
| D. | 该反应中,氧元素氧化了硫元素 |
15.下表中“试剂”与“操作及现象”对应关系错误的是( )
| 选项 | 试剂 | 操作及现象 |
| A | AgNO3溶液 | 滴加氨水,产生沉淀;继续滴加氨水,沉淀溶解 |
| B | 铝粉 | 滴加NaOH溶液,产生气体;继续滴加,产生白色沉淀 |
| C | CuSO4溶液 | 加过量NaOH溶液,产生蓝色沉淀;再加乙醛,加热,产生红色沉淀 |
| D | 氯水 | 滴加NaOH溶液,溶液颜色褪去;再加HCl,溶液颜色恢复 |
| A. | A | B. | B | C. | C | D. | D |
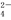 全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )