题目内容
高纯氧化锌广泛应用于电子工业,某研究小组设计如下流程制备高纯氧化锌。
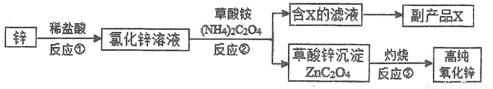
(1)反应①的化学方程式为___________________。
(2)反应②的基本反应类型是_____________。
(3)副产品X的化学式为:______________。从含X的滤液中获取固体X的实验操作步骤是:___________、____________、过滤。
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为_________、________。
(5)若用纯度为97.5%的1kg粗锌制备高纯氧化锌,理论上最多可生产出氧化锌的物质的量为:_________mol。
练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
4.下列物质中含有的化学键既有离子键又有非极性共价键的是( )
| A. | MgCl2 | B. | Na2O2 | C. | H2SO4 | D. | NaOH |
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.8g H218O中含有的中子数为NA | |
| B. | 1mol Fe与足量的浓硫酸反应,生成SO2的分子数为NA | |
| C. | 7.1g Cl2溶于水所得溶液中含有的Cl-数目为0.1NA | |
| D. | 丙烷燃料电池负极消耗2.24L(标准状况)气体时,电路中转移电子数为2NA |
2.高温下,2.8g铁粉与水蒸气反应,向反应后所得固体物中加入足量硝酸,得到NO和NO2混合气体1.008L(标准状况),则反应后所得固体物中未参加反应的铁可能是( )
| A. | 0.595g | B. | 1.42g | C. | 2.485g | D. | 2.72g |
20.短周期元素M、W、X、Y、Z的原子序数依次增大,M元素的一种核素没有中子,且M、W、X、Y、Z的最外层电子数与其电子层数的比值依次为l、2、3、4、2(不考虑零族元素).下列关于这些元素的叙述正确的是( )
| A. | X分别和其他四种元素均可形成至少2种化合物 | |
| B. | M、W、X、Y、Z的原子半径由大到小的顺序为Y>Z>X>W>M | |
| C. | X气态氢化物的稳定性大于Z态氢化物,但是X气态氢化物的沸点小于Z气态氢化物 | |
| D. | M、X、Y组成化合物和Y、Z组成化合物,它们所含的化学键类型完全相同 |