题目内容
14.在炼铜的过程中发生:Cu2S+2Cu2O═6Cu+SO2↑,则下列叙述正确的是( )| A. | 该反应从电子转移角度看,与SO2+H2O═H2SO3是同一反应类型 | |
| B. | 该反应从电子转移角度看,每生成6mol铜,转移电子12mol | |
| C. | 该反应中,Cu2S既是还原剂又是氧化剂 | |
| D. | 该反应中,氧元素氧化了硫元素 |
分析 Cu2S+2Cu2O═6Cu+SO2↑中,Cu元素的化合价降低,S元素的化合价升高,以此来解答.
解答 解:A.Cu2S+2Cu2O═6Cu+SO2↑中,Cu、S元素的化合价变化,而SO2+H2O═H2SO3中没有元素的化合价变化,不是氧化还原反应,故A错误;
B.每生成6mol铜,转移电子为6mol×(1-0)=6mol,故B错误;
C.Cu元素的化合价降低,S元素的化合价升高,所以Cu2S既是还原剂又是氧化剂,故C正确;
D.O元素的化合价不变,Cu元素的化合价降低,则Cu元素氧化硫元素,故D错误;
故选C.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.8g H218O中含有的中子数为NA | |
| B. | 1mol Fe与足量的浓硫酸反应,生成SO2的分子数为NA | |
| C. | 7.1g Cl2溶于水所得溶液中含有的Cl-数目为0.1NA | |
| D. | 丙烷燃料电池负极消耗2.24L(标准状况)气体时,电路中转移电子数为2NA |
2.高温下,2.8g铁粉与水蒸气反应,向反应后所得固体物中加入足量硝酸,得到NO和NO2混合气体1.008L(标准状况),则反应后所得固体物中未参加反应的铁可能是( )
| A. | 0.595g | B. | 1.42g | C. | 2.485g | D. | 2.72g |
9.如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中不正确的是( )

| A. | 铜电极应与X相连接 | |
| B. | H+透过质子交换膜由左向右移动 | |
| C. | M电极反应式为CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25 mol气体时,则理论上铁电极增重32 g |
6.下列说法正确的是( )
| A. | 某温度下水的离子积常数为Kw,在该温度下,a mol•L-1一元酸HA与b mol•L-1一元碱BOH等体积混合,溶液呈中性,则溶液中c(H+)=$\sqrt{Kw}$ | |
| B. | 已知MgCO3的Ksp=6.82×10-6mol2•L-2,则在含有固体MgCO3的Na2CO3溶液中,有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| C. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度 | |
| D. | NH4Cl和NH3•H2O的混合溶液中,分别存在NH4+的水解平衡和NH3•H2O的电离平衡,二者对对方的平衡都起了促进作用 |
3.已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图(不考虑I2+I-?I3-)下列说法不正确的是( )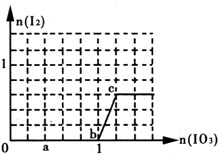

| A. | a点时消耗NaHSO3的物质的量为1.2 mol,得到的氧化产物为SO42- | |
| B. | b~c段的反应可用如下离子方程式表示:IO3-+5 I-+6H+═3I2+3H2O | |
| C. | 滴加过程中水的电离平衡一直逆向移动 | |
| D. | 从c点后所得混合液中分离出碘的操作为:加四氯化碳萃取分液,然后蒸馏 |
4.下列有关海水综合利用的说法正确的是( )
| A. | 利用潮汐发电是将化学能转化为电能 | |
| B. | 蒸馏法淡化海水的过程中一定发生了化学变化 | |
| C. | 从海水中可以获得MgCl2,电解熔融MgCl2可制备Mg | |
| D. | 可以用分液的方法将海水淡化 |