题目内容
7.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决温室效应的有效途径.已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)的平衡常数为K2.
在不同温度时K1、K2的值如下表:
| 温度(绝对温度) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(2)通过K值的计算,(1)中的反应是吸热反应(填“吸热”或“放热”).
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2O(气),在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件.各物质的浓度变化如下表:
| 时间/min | CO2 | H2O | CO | H2 |
| 0 | 0.2000 | 0.3000 | 0 | 0 |
| 2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | |
| 5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
| 6 | 0.0350 | 0.1350 | 0.1650 |
②在3~4min之间,反应处于平衡状态(填“平衡”或“非平衡”).
③第6min时,平衡向正反应方向移动,可能的原是升高温度或降低了H2浓度.
分析 (1)利用盖斯定律计算平衡常数K1、K2与K3之间的关系式;
(2)根据温度升高平衡常数的变化判断,由表中数据知升温平衡常数变大,说明平衡正向移动;
(3)①根据v=$\frac{△c}{△t}$计算;
②根据可逆反应特征:可逆反应到达平衡时,各组分的浓度保持不变;
③6min时,CO2浓度降低、H2O的浓度减小、CO的浓度增大,平衡正向移动,可能是改变温度或移走水蒸气.
解答 解:(1)已知:①Fe(s)+CO2(g)?FeO(s)+CO(g);K1=$\frac{c(CO)}{c(C{O}_{2})}$
②Fe(s)+H2O(g)?FeO(s)+H2(g);K2=$\frac{c({H}_{2})}{c({H}_{2}O)}$
利用盖斯定律将①-②可得:③H2(g)+CO2(g)?CO(g)+H2O(g);该反应的k=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$=$\frac{{K}_{1}}{{K}_{2}}$;
故答案为:K=$\frac{{K}_{1}}{{K}_{2}}$
(2)由表中数据可知,温度升高,①的平衡常数增大,说明平衡向正反应方向移动,则正反应吸热;
故答案为:吸热;
(3)①前2min,用CO表示的该化学反应的速率c(CO)=$\frac{0.026mol÷10L}{2min}$=0.0130mol•L-1•min-1;
故答案为:v(CO)=0.0130mol•L-1•min-1
②由表中数据可知,3min、4min时,反应混合物对应物质的浓度不变,处于与平衡状态;
故答案为:平衡;
③表6min时,CO2浓度降低、H2O的浓度减小、CO的浓度增大,说明平衡向正反应移动,正反应为吸热反应,可能是升高温度,由于氢气物质的量未知,也可能是降低氢气浓度;
故答案为:正反应;升高温度或降低了H2浓度.
点评 本题考查化学平衡计算与影响因素、平衡常数、反应速率、平衡状态特征等,考查学生分析解决问题的能力,难度中等.注意对基础知识的运用.

| A. | 都是σ键,没有π键 | B. | 都是π键,没有σ键 | C. | 既有π键,又有σ键 | D. | 除CH4外,都是σ键 |
| A. | Ba(OH)2 和盐酸;Ba(OH)2和 H2SO4 | |
| B. | BaCl2和Na2SO4;Ba(OH)2和(NH4)2SO4 | |
| C. | Ca(OH)2溶液通过量CO2; NaOH溶液通过量CO2 | |
| D. | Ba(OH)2和 HNO3; Cu (OH)2和 H2SO4 |
| A. | 35Cl原子所含质子数为18 | |
| B. | 1mol的1H35Cl分子所含中子数为18个 | |
| C. | 7g的35Cl2气体的体积为2.24L | |
| D. | 35Cl2气体的摩尔质量为70g/mol |
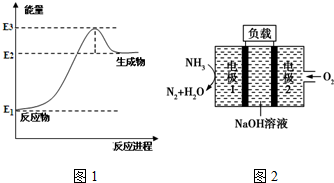
(1)以甲烷为原料可制得合成氨气用的氢气.图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和1mol H2(g)的能量变化示意图,写出该反应的热化学方程式CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1)kJ/mol(△H用E1、E2、E3表示).
(2)已知合成氨反应的平衡常数K值和温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.68 | 0.5 |
②400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(3)①在25℃下,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$;
②向25mL 0.10mol•L-1的盐酸中滴加氨水至过量,该过程中离子浓度大小关系一定不正确的是d(填字母序号).
a.c(Cl-)>c(H+)>c(NH4+)>c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(4)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图2所示,电极1发生的电极反应式为2NH3+6OH--6e-=N2↑+6H2O.
| A. | 67% | B. | 50% | C. | 25% | D. | 10% |
N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是( )
| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l);△H=-1135.7 kJ/mol | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g);△H=-1000.3 kJ/mol | |
| C. | N2H4(g)+NO2(g)═N2(g)+2H2O(l);△H=-1135.7 kJ/mol | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g);△H=-1135.7 kJ/mol |
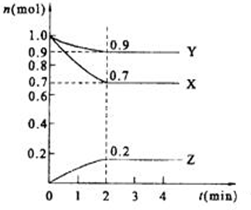 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.