题目内容
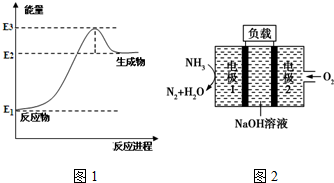
2.用途广泛,是最重要的化工产品之一,请回答下列问题:(1)以甲烷为原料可制得合成氨气用的氢气.图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和1mol H2(g)的能量变化示意图,写出该反应的热化学方程式CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1)kJ/mol(△H用E1、E2、E3表示).
(2)已知合成氨反应的平衡常数K值和温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.68 | 0.5 |
②400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(3)①在25℃下,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$;
②向25mL 0.10mol•L-1的盐酸中滴加氨水至过量,该过程中离子浓度大小关系一定不正确的是d(填字母序号).
a.c(Cl-)>c(H+)>c(NH4+)>c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(4)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图2所示,电极1发生的电极反应式为2NH3+6OH--6e-=N2↑+6H2O.
分析 (1)根据图示信息,反应物的能量低于产物的能量,所以反应是吸热反应,反应热等于产物的能量和反应物的能量之差,据此回答;
(2)①分析图表,温度升高k变小,说明反应逆向移动,正反应为放热反应;
②计算400°C时,某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时的浓度商QC,与k比较可得;
(3)①在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3•H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$;
②a、滴加很少量氨水时,c(Cl-)>c(H+)>c(NH4+)>c(OH-);
b、盐酸稍稍过量时:c(Cl-)>c(NH4+)=c(H+)>c(OH-);
c、体系为NH4Cl溶液和NH3.H2O,氨水过量较多时,溶液呈碱性:c(NH4+)>c(OH-)>c(Cl-)>c(H+);
d、盐酸是1:1的电离氢离子,氢离子被氨水中和一部分,所以c(H+)不可能大于 c(Cl-);
(4)分析电极1NH3生成N2,氮元素化合价升高,说明失电子,再结合电解液写.
解答 解:(1)根据图示信息,反应物的能量低于产物的能量,所以反应是吸热反应,反应热等于产物的能量和反应物的能量之差,即CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1)kJ/mol;
故答案为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1)kJ/mol;
(2)①)①分析图表,温度升高k变小,说明反应逆向移动,正反应为放热反应;
故答案为:温度升高,平衡常数减小;
②400°C时,k=0.5氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时的浓度商QC=$\frac{3^2}{2×1^3}$=4.5>0.5,此时反应正向着逆方向进行;
故答案为:<;
(3)①在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-7}×0.005}{0.5a-0.005}$=$\frac{1{0}^{-8}}{a-0.1}$;
故答案为:$\frac{{{{10}^{-8}}}}{a-0.1}$;
②a、滴加很少量氨水时,c(Cl-)>c(H+)>c(NH4+)>c(OH-),故a正确;
b、盐酸稍稍过量时:c(Cl-)>c(NH4+)=c(H+)>c(OH-)故b正确;
c、体系为NH4Cl溶液和NH3.H2O,氨水过量较多时,溶液呈碱性:c(NH4+)>c(OH-)>c(Cl-)>c(H+),故c正确;
d、盐酸是1:1的电离氢离子,氢离子被氨水中和一部分,所以c(H+)不可能大于 c(Cl-),故d错误;
故答案为:d;
(4)电极1NH3生成N2,氮元素化合价升高,说明失电子,电解质溶液为碱性电子,所以电极1的电极反应式为:2NH3+6OH--6e-=N2↑+6H2O;
故答案为:2NH3+6OH--6e-=N2↑+6H2O.
点评 本题考查了反应热的计算、化学平衡问题、离子浓度大小的比较、燃料电池电极反应式的书写,综合性很强,明确溶液中的溶质是离子浓度大小比较的基础,注意结合电荷守恒来分析解答.

| A. | x:y=3:1 | B. | v(A):v(C)=2:1 | ||
| C. | A的平衡浓度为0.4mol/L | D. | A与B的平衡浓度之比为3:2 |
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍、四种溶液的pH:①>②>④>③ | |
| B. | 温度下降10℃,四种溶液的pH均不变 | |
| C. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c(Cl-)<c(NH4+)<c(H+)<c(OH-) |
| A. | 石墨比金刚石稳定 | B. | 12 g金刚石的能量比12 g石墨的低 | ||
| C. | 金刚石比石墨稳定 | D. | 金刚石和石墨不能相互转化 |
已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)的平衡常数为K2.
在不同温度时K1、K2的值如下表:
| 温度(绝对温度) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(2)通过K值的计算,(1)中的反应是吸热反应(填“吸热”或“放热”).
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2O(气),在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件.各物质的浓度变化如下表:
| 时间/min | CO2 | H2O | CO | H2 |
| 0 | 0.2000 | 0.3000 | 0 | 0 |
| 2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | |
| 5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
| 6 | 0.0350 | 0.1350 | 0.1650 |
②在3~4min之间,反应处于平衡状态(填“平衡”或“非平衡”).
③第6min时,平衡向正反应方向移动,可能的原是升高温度或降低了H2浓度.
| A. | 溶液中I-浓度减小 | B. | 溶度积常数Ksp增大 | ||
| C. | 沉淀溶解平衡向左移动 | D. | 溶液中Pb2+浓度增大 |
| A. | CaO和KCl | B. | CuO和NaCl | C. | BaSO4和CaCO3 | D. | NaCl和AgNO3 |