题目内容
9.下列说法中,正确的是( )| A. | 强电解质的水溶液一定比弱电解质溶液的导电能力强 | |
| B. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不溶性盐都是弱电解质,可溶性盐都是强电解质 |
分析 A.溶液导电能力取决于溶液中离子浓度大小,与电解质强弱无关;
B.某些共价化合物是强电解质;
C.强电解质完全电离成离子;
D.某些不溶性盐是强电解质;某些可溶性酸是弱电解质;某些具有极性键的化合物是弱强电解.
解答 解:A.溶液的导电能力与溶液中离子浓度成正比,与电解质的强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液强,故A错误;
B.强电解质不一定都是离子化合物,如氯化氢;弱电解质都是共价化合物,故B错误;
C.强电解质的特征是水溶液中完全电离,所以不存在溶质分子,故C正确;
D.不溶性盐不一定是弱电解质,如硫酸钡;可溶性酸不一定是强电解质,如醋酸;具有极性键的化合物不一定是强电解,如甲烷,故D错误,
故选C.
点评 本题考查了溶液导电性分析判断,强弱电解质的组成特征分析,难度不大.掌握理解概念是解题关键.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
14.工业制硝酸过程中的一个重要反应为4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.下列有关该反应的说法正确的是( )
| A. | O2是还原剂 | B. | NH3是氧化剂 | C. | O2得到电子 | D. | NH3发生还原反应 |
1.下列装置或操作能达到实验目的是( )
| A. |  实验室室制取并收集NH3 | B. |  构成铜锌原电池 | ||
| C. |  检查装置气密性 | D. |  利用排空气法收集CO2 |
2.按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物.下列反应符合“原子经济”原理的是( )
| A. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2SO2↑+2H2O | |
| B. | Cu+4NHO3(浓)=Cu(NO3)2+2NO2↑+2H2O | |
| C. | CH2=CH2+Br2→CH2Br-CH2Br | |
| D. | 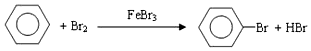 |

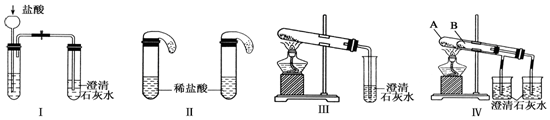
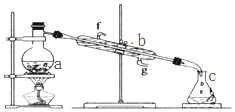 掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置.
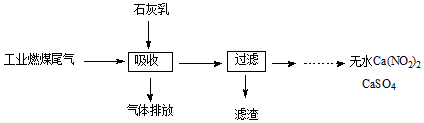
掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置. 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.