题目内容
2.按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物.下列反应符合“原子经济”原理的是( )| A. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2SO2↑+2H2O | |
| B. | Cu+4NHO3(浓)=Cu(NO3)2+2NO2↑+2H2O | |
| C. | CH2=CH2+Br2→CH2Br-CH2Br | |
| D. | 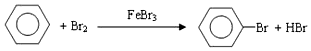 |
分析 “原子经济”就是反应物的原子全部转化为期望的最终产物,对于无机反应来说应该是化合反应,对于有机反应来说应该是加成反应或加聚反应,据此分析解答.
解答 解:“原子经济”就是反应物的原子全部转化为期望的最终产物,对于无机反应来说应该是化合反应,对于有机反应来说应该是加成反应或加聚反应,
A.该反应中除了生成硫酸铜外还生成二氧化硫和水,不符合原子经济,故A错误;
B.该反应中除了生成硝酸铜外还生成二氧化氮和水,不符合原子经济,故B错误;
C.该反应为加成反应,产物只有一种,符合原子经济,故C正确;
D.该反应为取代反应,除了生成溴苯外还生成HBr,不符合原子经济,故D错误;
故选C.
点评 本题考查原子经济,为高频考点,侧重考查学生获取信息解答问题能力,正确理解原子经济概念是解本题关键,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
9.下列说法中,正确的是( )
| A. | 强电解质的水溶液一定比弱电解质溶液的导电能力强 | |
| B. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不溶性盐都是弱电解质,可溶性盐都是强电解质 |
13. 硼及其化合物在工业中有重要应用,已知以下几个反应:
硼及其化合物在工业中有重要应用,已知以下几个反应:
Ⅰ.BCl3(g)+3H2O(I)=H3BO3(s)+3HCl(g)△H1
Ⅱ.B2O3(s)+3C(s)+3Cl2(g)?2BCl3(g)+3CO(g)△H2
Ⅲ.H3BO3(aq)+H2O(I)?[B(OH)4]-(aq)+H+(aq)
Ⅳ.H3BO3(I)+3CH3OH(I)?B(OCH3)3(I)+3H2O(I)
(1)已知硼酸的结构是: ,反应Ⅰ中相关化学键键能数据如下:
,反应Ⅰ中相关化学键键能数据如下:
由此计算△H1=-1044KJ•mol-1.
(2)已知△H2>0,既能使反应Ⅱ平衡向正反应方向移动,又能加快反应速率的措施是bc.
a.加压 b.升温 c.增大Cl2的浓度 d.移走部分BCl3 e.加入适当的催化剂 f.增大焦炭的量
(3)写出反应Ⅲ的平衡常数表达式K=$\frac{[[B(OH){\;}_{4}]{\;}^{-}][H{\;}^{+}]}{[{H}_{3}B{O}_{3}]}$;写出阴离子[B(OH)4]-的电子式: .
.
(4)在反应Ⅳ中,H3BO3的转化率在不同温度下随反应时间(t)的变化如图,若T=333K,初始c(H3BO3)=1mol•L-1,则0~10min的反应速率v(H3BO3)=0.08mol/(L•min);40min达到平衡后,改变温度为T,c(H3BO3 )以0.005mol•L-1•min-1的平均速率降低,经过10min又达到平衡,则T>333K(用“>”、“<”、“=”填空),温度对该反应的速率和平衡移动的影响是升高温度反应速率加快,平衡向正向移动.
 硼及其化合物在工业中有重要应用,已知以下几个反应:
硼及其化合物在工业中有重要应用,已知以下几个反应:Ⅰ.BCl3(g)+3H2O(I)=H3BO3(s)+3HCl(g)△H1
Ⅱ.B2O3(s)+3C(s)+3Cl2(g)?2BCl3(g)+3CO(g)△H2
Ⅲ.H3BO3(aq)+H2O(I)?[B(OH)4]-(aq)+H+(aq)
Ⅳ.H3BO3(I)+3CH3OH(I)?B(OCH3)3(I)+3H2O(I)
(1)已知硼酸的结构是:
 ,反应Ⅰ中相关化学键键能数据如下:
,反应Ⅰ中相关化学键键能数据如下:| 化学键 | H-O | H-Cl | B-O | B-Cl |
| E(KJ•mol-1) | 465 | 431 | 809 | 427 |
(2)已知△H2>0,既能使反应Ⅱ平衡向正反应方向移动,又能加快反应速率的措施是bc.
a.加压 b.升温 c.增大Cl2的浓度 d.移走部分BCl3 e.加入适当的催化剂 f.增大焦炭的量
(3)写出反应Ⅲ的平衡常数表达式K=$\frac{[[B(OH){\;}_{4}]{\;}^{-}][H{\;}^{+}]}{[{H}_{3}B{O}_{3}]}$;写出阴离子[B(OH)4]-的电子式:
 .
.(4)在反应Ⅳ中,H3BO3的转化率在不同温度下随反应时间(t)的变化如图,若T=333K,初始c(H3BO3)=1mol•L-1,则0~10min的反应速率v(H3BO3)=0.08mol/(L•min);40min达到平衡后,改变温度为T,c(H3BO3 )以0.005mol•L-1•min-1的平均速率降低,经过10min又达到平衡,则T>333K(用“>”、“<”、“=”填空),温度对该反应的速率和平衡移动的影响是升高温度反应速率加快,平衡向正向移动.
10.下列各组中的离子,能在水溶液中大量共存的是( )
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、Cu2+、SO42-、Cl- | D. | Na+、H+、Cl-、CO32- |
17.下列实验操作正确的是( )
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液时,分液漏斗中的两层液体均从下口放出 | |
| C. | 蒸馏时,应将温度计水银球靠近蒸馏烧瓶支管口处 | |
| D. | 称量NaOH固体时,将氢氧化钠固体放在托盘天平左盘的纸上 |
7.能正确表示下列化学反应的离子方程式的是( )
| A. | 石灰水与盐酸的反应 OH-+H+═H2O | |
| B. | 氧化铜与盐酸反应 O2-+2H+═H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于醋酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
14.已知H-H键键能(断裂时吸收或生成时释放的能量)为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)=2NH3(g);△H=-92kJ•mol-1.计算N≡N键的键能是( )
| A. | 431kJ•mol-1 | B. | 649kJ•mol-1 | C. | 896kJ•mol-1 | D. | 946kJ•mol-1 |
12.碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:
S2O82-+2I-?2SO42-+I2(慢)
I2+2S2O32-?2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3 耗尽后,溶液颜色将由无色变为蓝色
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
表中Vx=2.0 mL,理由是保证反应物K2S2O8浓度改变,而其他的条件不变,才能达到实验目的 .
已知:
S2O82-+2I-?2SO42-+I2(慢)
I2+2S2O32-?2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3 耗尽后,溶液颜色将由无色变为蓝色
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
 .
.