题目内容
2.X、Y、Z、W、Q为原子序数依次增大的五种元素,X失去一个电子可转化为质子,Y的基态原子的核外电子占据四个原子轨道,Z的质子数与X、Y的质子数之和相等,W是第三周期中原子半径最小的元素,Q核外电子总数比X、Y、Z、W核外电子总数之和多2.(1)Q原子的核外电子排布式为1s22s22p63s23p63d104s24p3,基态Z原子的电子共占据9个原子轨道.
(2)X、Y、Z三种元素的电负性由大到小的顺序是N>C>H(填元素符号);Z与Q中,第一电离能较大的是N(填元素符号);化合物Y2X4的化学性质比Y2X6活泼许多,其原因是乙烯中含有碳碳双键、乙烷中不含碳碳双键.
(3)ZX3、Z2X4分子中的中心原子的杂化轨道类型为sp3;sp3,ZX3的立体构型为三角锥形.
(4)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,则这两种氧化物的分子式分别是CO2、N2O.
分析 X、Y、Z、W、Q为原子序数依次增大的五种元素,X失去一个电子可转化为质子,则X为H元素;
Y的基态原子的核外电子占据四个原子轨道,则Y是C元素;
Z的质子数与X、Y的质子数之和相等,则Z为N元素;
W是第三周期中原子半径最小的元素,为Cl元素;
Q核外电子总数比X、Y、Z、W核外电子总数之和多2,则Q核外电子数=1+6+7+17+2=33,
为As元素;
(1)Q原子核外有33个电子,根据构造原理书写Q原子的核外电子排布式,基态Z原子的电子占据的轨道有1个1s、1个2s、3个2p、1个3s、3个3p;
(2)元素的非金属性越强,其电负性越大;
同一主族元素,元素的第一电离能随着原子序数增大而减小;
烯烃中含有碳碳双键、烷烃中只含碳碳单键,碳碳双键中含有π键导致烯烃较活泼;
(3)根据价层电子对互斥理论判断ZX3、Z2X4分子中的中心原子的杂化轨道类型、ZX3的立体构型;
(4)原子个数相同、价电子数相同的微粒互为等电子体.
解答 解:X、Y、Z、W、Q为原子序数依次增大的五种元素,X失去一个电子可转化为质子,则X为H元素;
Y的基态原子的核外电子占据四个原子轨道,则Y是C元素;
Z的质子数与X、Y的质子数之和相等,则Z为N元素;
W是第三周期中原子半径最小的元素,为Cl元素;
Q核外电子总数比X、Y、Z、W核外电子总数之和多2,则Q核外电子数=1+6+7+17+2=33,
为As元素;
(1)Q原子核外有33个电子,根据构造原理书写Q原子的核外电子排布式1s22s22p63s23p63d104s24p3,基态Z原子的电子占据的轨道有1个1s、1个2s、3个2p、1个3s、3个3p,共有9个轨道,
故答案为:1s22s22p63s23p63d104s24p3;9;
(2)元素的非金属性越强,其电负性越大,H、C、N的非金属性N>C>H,则电负性N>C>H;
同一主族元素,元素的第一电离能随着原子序数增大而减小,所以第一电离能N>As;
烯烃中含有碳碳双键、烷烃中只含碳碳单键,碳碳双键中含有π键导致烯烃较活泼,乙烯中含有碳碳双键、乙烷中不含碳碳双键,所以乙烯比乙烷活泼,
故答案为:N>C>H;N;乙烯中含有碳碳双键、乙烷中不含碳碳双键;
(3)ZX3分子中价层电子对个数是4且含有一个孤电子对、Z2X4分子中的中心原子价层电子对个数是4且含1个孤电子对,根据价层电子对互斥理论判断ZX3、Z2X4分子中的中心原子的杂化轨道类型都是sp3,ZX3的立体构型三角锥形,
故答案为:sp3;sp3;三角锥形;
(4)原子个数相同、价电子数相同的微粒互为等电子体,元素C的一种氧化物与元素N的一种氧化物互为等电子体,则这两种氧化物的分子式分别是CO2、N2O,
故答案为:CO2;N2O.
点评 本题考查位置结构相互关系及应用,为高频考点,涉及等电子体判断、原子杂化方式判断、分子空间构型判断、原子核外电子排布等知识点,侧重考查学生分析判断及知识综合应用能力,明确基本原理、原子结构是解本题关键,注意价层电子对互斥理论的应用,题目难度不大.

| A. | 可逆反应 | B. | 任何反应 | C. | 溶液间反应 | D. | 气体间反应 |
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O7 2-+14H++6Fe2+=2Cr3+(绿色)+6Fe3++7H2O.
下列分析正确的是( )
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O7 2->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
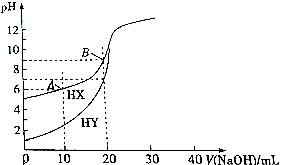
| A. | 相同条件下,HX和HY中和碱的能力相同 | |
| B. | 常温下,HX的电离平衡常数K=1×10-9mol•L-1 | |
| C. | 点存在:c(X-)-c(HX)>c(H+)-c(0H-) | |
| D. | 向B点溶液通人HCl气体至中性:c(HX)+c(Cl-)+2c(X-)=0.2mol•L-1A |
| A. | 0.5mol37Cl2和16g O2 | B. | 5.6L N2(标准状况)和11g CO2 | ||
| C. | 20g D2O和10g H2 | D. | 224mL D2和0.1mol N2 |
| A. | 双氧水使酸性KMnO4溶液的红色褪去:3H2O2+2MnO4-+6H+=2Mn2++4O2↑+6H2O | |
| B. | HClO4的电离方程式:HClO4=H++ClO4- | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | Fe2+被空气氧化:4Fe2++O2+2H2O=4Fe3++4OH- |
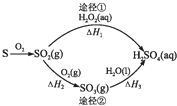
| A. | 已知S(l)+O2(g)═SO2(g)△H=-293.23kJ•mol-1,则S(s)+O2(g)═SO2(g)反应放出的热量小于293.23 kJ/mol | |
| B. | 含1 mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热 | |
| C. | 途径②中SO2和SO3均属于酸性氧化物 | |
| D. | 若△H1<△H2+△H3,则2H2O2(aq)═2H2O(l)+O2(g)为放热反应 |
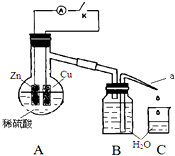 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)=ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2 时的反应热△H=-158kJ/mol.
(4)该同学用如图装置进行实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.