题目内容
10.已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O7 2-(橙色)+H2O?2H++2CrO42- (黄色),①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O7 2-+14H++6Fe2+=2Cr3+(绿色)+6Fe3++7H2O.
下列分析正确的是( )
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O7 2->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
分析 A、溶液由橙色变为黄色,溶液由黄色变为橙色,说明加入酸碱发生平衡移动;
B、氧化剂的氧化性大于氧化产物分析判断;
C、CrO42-具有氧化剂酸性溶液中氧化亚铁离子;
D、稀释溶液,平衡状态下离子浓度减小,氢离子浓度减小,溶液中存在离子积,氢氧根离子浓度增大.
解答 解:A、加入氢氧化钠溶液,溶液由橙色变为黄色,说明平衡正向进行,加入硫酸溶液由黄色变为橙色,说明平衡逆向进行,说明加入酸碱发生平衡移动,实验①能证明K2Cr2O7溶液中存在上述平衡,实验②不能证明K2Cr2O7溶液中存在上述平衡,故A错误;
B、反应中Cr2O72-+14H++6Fe2+═2Cr3+(绿色)+6Fe3++7H2O,氧化剂的氧化性大于氧化产物,所以实验②能说明氧化性:Cr2O72->Fe3+,故B正确;
C、CrO42-具有氧化剂酸性溶液中氧化亚铁离子,CrO42-和Fe2+在酸性溶液中不可以大量共存,故C错误;
D、稀释K2Cr2O7溶液时,平衡状态下离子浓度减小,氢离子浓度减小,由离子积不变可知,氢氧根离子浓度增大,故D错误;
故选B.
点评 本题考查了盐类水解的分析应用,氧化还原反应的规律分析,平衡移动原理的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.某化合物由A,B 2种元素组成,已知A,B两元素的质量比为7:4,相对原子质量之比为7:8,则此化合物分子式可能是( )
| A. | A2B | B. | AB | C. | AB2 | D. | A2B4 |
18.已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 | B. | 2H2(g)+O2(g)+2H2O(l);△H=-484kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g);△H=-484kJ•mol-1 |
5.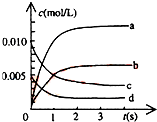 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)800℃,反应达到平衡时,NO的物质的量的浓度是0.0035mol/L;
(2)图中表示NO2的浓度变化曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是be.
a、v (NO2)=2v (O2)
b、容器内压强保持不变
c、v逆(NO)=v正(O2)
d、容器内混合气体的密度保持不变
e、该容器内颜色保持不变.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的浓度变化曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是be.
a、v (NO2)=2v (O2)
b、容器内压强保持不变
c、v逆(NO)=v正(O2)
d、容器内混合气体的密度保持不变
e、该容器内颜色保持不变.
2. 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
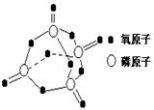
已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如右图所示,则上表中X为( )
 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如右图所示,则上表中X为( )
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 434 | B. | 335 | C. | 237 | D. | 188 |
3.下列说法正确的是( )
| A. | 同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类 | |
| B. | 短周期元素中同主族元素X的原子序数不可能是Y的2倍 | |
| C. | L层上的电子数为奇数的元素一定是主族元素 | |
| D. | 目前使用的元素周期表中,最长的周期含36种元素 |
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: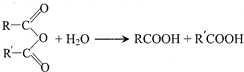
 中的官能团名称为醛基、羟基
中的官能团名称为醛基、羟基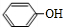 ,DCH3COOH,G
,DCH3COOH,G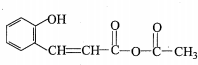

 )氮原子上的氢原子可以像A上的氢原子一样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
)氮原子上的氢原子可以像A上的氢原子一样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式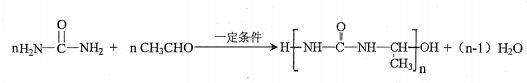
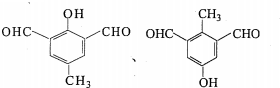 .
.