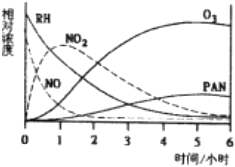
题目内容
14.图为两种途径制备硫酸的过程,反应条件略.下列说法错误的是( )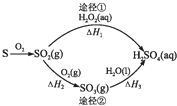
| A. | 已知S(l)+O2(g)═SO2(g)△H=-293.23kJ•mol-1,则S(s)+O2(g)═SO2(g)反应放出的热量小于293.23 kJ/mol | |
| B. | 含1 mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热 | |
| C. | 途径②中SO2和SO3均属于酸性氧化物 | |
| D. | 若△H1<△H2+△H3,则2H2O2(aq)═2H2O(l)+O2(g)为放热反应 |
分析 A.固态硫的能量低于液态硫,所以液态硫燃烧放热多;
B.中和反应的定义:强酸与强碱的稀溶液混合生成1mol水放出的热量为中和热;
C.二氧化硫与三氧化硫都能够与碱溶液反应生成盐和水,属于酸性氧化物;
D.△H1是二氧化硫与双氧水反应的焓变△H4、双氧水分解的焓变△H5之和,根据盖斯定律:△H4=△H2+△H3,则双氧水分解的焓变△H5=△H1-(△H2+△H3),据此判断双氧水分解的焓变即可.
解答 解:A.硫在固态时具有的能量小于液态,则固体硫单质燃烧放出的热量小于293.23 kJ/mol,故A正确;
B.含l mol H2S04的浓溶液与足量NaOH反应生成2mol水,且浓溶液溶于水放热,所以该反应放出的热量不是中和热,故B错误;
C.二氧化硫和三氧化硫对应的酸分别为亚硫酸、硫酸,则二氧化硫与三氧化硫均属于酸性氧化物,故C正确;
D.由于△H1<△H2+△H3,说明△H1是二氧化硫与双氧水反应的焓变△H4、双氧水分解的焓变△H5之和,根据盖斯定律△H4=△H2+△H3,则双氧水分解的焓变△H5=△H1-(△H2+△H3)<0,焓值小于0,说明2H2O2(aq)═2H2O(l)+O2(g)为放热反应,故D正确,
故选B.
点评 本题考查较为综合,涉及化学反应吸热与放热的判断、酸性氧化物和中和热的概念等知识,题目难度中等,明确 化学反应与能量变化的关系为解答关键,D为易错点,注意△H1是二氧化硫与双氧水反应的焓变△H4、双氧水分解的焓变△H5之和,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
2. 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
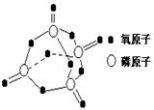
已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如右图所示,则上表中X为( )
 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如右图所示,则上表中X为( )
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 434 | B. | 335 | C. | 237 | D. | 188 |
9.下列清洁剂能与常用的肥皂最为接近的是( )
| A. | CH3-(CH2)11C6H4-SO3Na | B. | CH3-(CH2)13-COOK | ||
| C. | CH3-(CH2)11-SO3Na | D. | CH3(CH2)nCH3(5≤n≤12) |
19.化学与生活密切相关,下列说法正确的是( )
| A. | Na2CO3与Al(OH)3都能够作为治疗胃酸过多的药品 | |
| B. | 可以用铝制器皿盛放浓硫酸和浓氢氧化钠溶液 | |
| C. | 医院里用高锰酸钾溶液和双氧水来消毒,是因为两者有某种共同的性质 | |
| D. | 在水中投入适量的氢氧化钠固体可以增大明矾的净水效果 |
6.图为元素周期表的一部分,请根据元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是H2SO4、HNO3 (用化学式表示,下同);碱性最强的是NaOH.
(2)④、⑤、⑥的简单离子半径由大到小的顺序是O2->Na+>Al3+ (用离子符号表示).
(3)由①、④、⑤、三种元素组成的化合物中化学键的类型有:离子键、共价键.
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族)2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO或Mg+H2SO4=MgSO4+H2↑;
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
A$→_{反应①}^{+X一定条件}$B$→_{反应②}^{+X一定条件}$C
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行.B的化学式为Al(OH)3.
对应的反应①的离子方程式为Al3++3OH-=Al(OH)3↓或【Al(OH)4】-+H+=Al(OH)3↓+H2O.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)④、⑤、⑥的简单离子半径由大到小的顺序是O2->Na+>Al3+ (用离子符号表示).
(3)由①、④、⑤、三种元素组成的化合物中化学键的类型有:离子键、共价键.
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族)2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO或Mg+H2SO4=MgSO4+H2↑;
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
A$→_{反应①}^{+X一定条件}$B$→_{反应②}^{+X一定条件}$C
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行.B的化学式为Al(OH)3.
对应的反应①的离子方程式为Al3++3OH-=Al(OH)3↓或【Al(OH)4】-+H+=Al(OH)3↓+H2O.
3.下列说法正确的是( )
| A. | 同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类 | |
| B. | 短周期元素中同主族元素X的原子序数不可能是Y的2倍 | |
| C. | L层上的电子数为奇数的元素一定是主族元素 | |
| D. | 目前使用的元素周期表中,最长的周期含36种元素 |
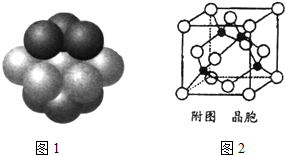 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: