题目内容
12.下列物质中:只存在共价键的是②⑧(填序号,下同),既存在离子键又存在极性共价键的是④⑥,只存在离子键的是③⑤.①Ar ②CO ③Na2O④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO2 ⑧H2SO4.
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,同种非金属元素形成非极性共价键,不同种非金属元素形成极性共价键,以此来解答.
解答 解:①Ar不含化学键;
②CO中只含C、O之间的极性共价键;
③Na2O中只含离子键;
④KOH中含离子键和O-H极性共价键;
⑤MgBr2中只含离子键;
⑥NH4Cl中含离子键和极性共价键;
⑦CaO2中含离子键和O-O非极性共价键;
⑧H2SO4中极性共价键,
则只存在共价键的是②⑧,既存在离子键又存在极性共价键的是④⑥,只存在离子键的是③⑤.
故答案为:②⑧;④⑥;③⑤.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
20.某化合物由A,B 2种元素组成,已知A,B两元素的质量比为7:4,相对原子质量之比为7:8,则此化合物分子式可能是( )
| A. | A2B | B. | AB | C. | AB2 | D. | A2B4 |
7.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获2002年诺贝尔化学奖.下面有关叙述正确的是( )
| A. | 13C与15N有相同的中子数 | B. | 13C与C60互为同素异形体 | ||
| C. | 15N 与14N 互为同位素 | D. | 232Th转化成233U是化学变化 |
4.有关苯的结构和性质,下列说法正确的是( )
| A. |  与 与 是同分异构体 是同分异构体 | |
| B. |  此反应是取代反应 此反应是取代反应 | |
| C. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| D. | 向2mL苯中加入1mL酸性高锰酸钾溶液,震荡后静置,可观察到液体分层,上层呈紫红色 |
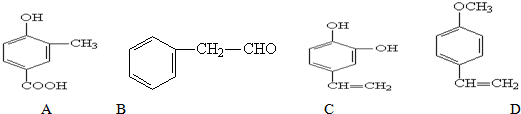
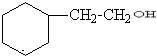 .
.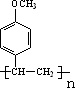 .
.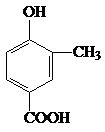 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O.
+H2O. 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: