题目内容
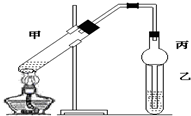
3.某研究性学习小组设计实验验证乙酸乙酯的性质:向两支试管中各加入6滴乙酸乙酯,然后向第一支试管中加1:5的稀硫酸0.5mL和蒸馏水5mL,向第二支试管中加30%的氢氧化钠溶液0.5m和蒸馏水5mL;分别振荡均匀,70t〜80T水浴加热,观察现象:①第一支试管中稀硫酸的作用是催化剂.
②写出乙酸乙酯与NaOH反应的化学方程式CH3COOCH2CH3+NaOH$\stackrel{H_{2}O}{→}$CH3COONa+CH3CH2OH.
分析 ①乙酸乙酯含-COOC-,在酸性条件下可发生水解反应;
②乙酸乙酯与NaOH反应,为水解反应,生成乙酸钠和乙醇,以此来解答.
解答 解:①乙酸乙酯含-COOC-,在酸性条件下可发生水解反应,则第一支试管中稀硫酸的作用是催化剂,
故答案为:催化剂;
②乙酸乙酯与NaOH反应,为水解反应,生成乙酸钠和乙醇,反应为CH3COOCH2CH3+NaOH$\stackrel{H_{2}O}{→}$CH3COONa+CH3CH2OH,
故答案为:CH3COOCH2CH3+NaOH$\stackrel{H_{2}O}{→}$CH3COONa+CH3CH2OH.
点评 本题考查有机物的结构与性质,为高频考点,把握乙酸乙酯的官能团及水解反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
5.下列各项操作中,发生“先产生沉淀,后沉淀又溶解”现象的是( )
①向Fe(OH)3胶体中逐滴加入过量的稀硫酸 ②向AlCl3溶液中通入过量的NH3
③向Ca(OH)2溶液中逐渐通入过量的CO2 ④向NaAlO2溶液中逐滴加入过量的盐酸.
①向Fe(OH)3胶体中逐滴加入过量的稀硫酸 ②向AlCl3溶液中通入过量的NH3
③向Ca(OH)2溶液中逐渐通入过量的CO2 ④向NaAlO2溶液中逐滴加入过量的盐酸.
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
8.实验室需配制一种强酸溶液500mL,c (H+)=2mol/L,下列配制方法可行的是( )
| A. | 取100mL5mol/LH2SO4,加入400mL水 | |
| B. | 取200mL5mol/LHCl,加水稀释至500mL | |
| C. | 取200 mL5mol/LH2SO4,加水稀释至500mL | |
| D. | 取100 mL5mol/LHNO3,加水稀释至500mL |
12.在标准状况下,1000mL某气体的质量为1.25g,则该气体可能是下列物质中的( )
| A. | 氨气 | B. | 氮气 | C. | 二氧化碳 | D. | 氧气 |
10.汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-Q kJ/mol(Q>0)实验模拟催化转换器,恒温恒压时用气体传感器测得不同时刻NO和CO的浓度如下表:
经分析,得出的下列结论正确的是( )
| 时间/s | 0 | 2 | 3 | 4 | 5 |
| c(NO)/10-3 mol•L-1 | 1.00 | 0.25 | 0.16 | 0.10 | 0.10 |
| c(CO)/10-3 mo l•L-1 | 3.60 | 2.85 | 2.76 | 2.70 | 2.70 |
| A. | 0~2 s间的平均反应速率v(NO)=3.75×10-3mol/(L•s) | |
| B. | 催化转化器对废气的转化速率在冬季时比夏季时高 | |
| C. | 选用更有效的催化剂可以提高污染物的转化率 | |
| D. | 该温度下,此反应的平衡常数K=5.0×103 |

 +CaCl2+H2O,该反应的原子利用率25.4%.
+CaCl2+H2O,该反应的原子利用率25.4%.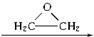 HO-CH2-CH2-O-CH2-CH2-OH
HO-CH2-CH2-O-CH2-CH2-OH