题目内容
15.对于反应X=2Y,△H=66.88kJ/mol,逆反应活化能为23.00kJ/mol.计算:(1)正反应活化能?
(2)已知0℃时,k1=1.60×10-3min-1,45℃时k2=?
分析 (1)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据正反应的活化能=逆反应的活化能+反应的焓变;
(2)根据X=2Y,△H=66.88kJ/mol为吸热反应,所以升温平衡正向移动,据此判断;
解答 解:(1)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据正反应的活化能=逆反应的活化能+反应的焓变=23.00kJ/mol+66.88kJ/mol=89.88kJ/mol,答:正反应活化能为89.88kJ/mol;
(2)根据X=2Y,△H=66.88kJ/mol为吸热反应,所以升温平衡正向移动,平衡常数变大,又0℃时,k1=1.60×10-3min-1,所以45℃时k2>1.60×10-3min-1;答:45℃时k2>1.60×10-3min-1.
点评 本题考查了反应活化能的判断计算,以及平衡常数的计算,焓变和活化能计算方法的理解是解题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.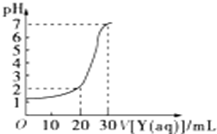 如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
 如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )| A | B | C | D | |
| HCl(mol/L) | 0.12 | 0.04 | 0.09 | 0.12 |
| NaOH(mol/L) | 0.04 | 0.12 | 0.03 | 0.06 |
| A. | A | B. | B | C. | C | D. | D |
20.粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④HCl,加入的先后顺序可以是( )
| A. | ①②③④ | B. | ②③①④ | C. | ②①③④ | D. | ③②④① |
4.下列由相关实验现象所推出的结论正确的是( )
| A. | Cl2、SO2均能品红溶液褪色,说明二者漂白原理相同 | |
| B. | 浓Na2SO4溶液和甲醛都能使蛋白质从溶液中析出,说明二者均使蛋白质发生盐析 | |
| C. | CO2、SO2使澄清石灰水变浑浊,说明二者均为酸性氧化物 | |
| D. | 溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
2. 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应:
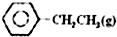 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$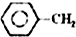 =CH2(g)+H2(g)
=CH2(g)+H2(g)
(1)已知:
计算上述反应的△H=+124KJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数Kp=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
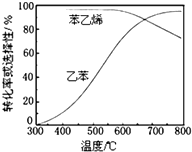
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: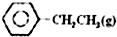 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$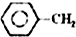 =CH2(g)+H2(g)
=CH2(g)+H2(g)(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数Kp=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
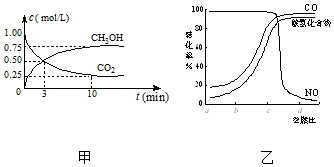 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.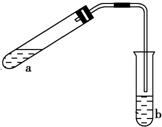 可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空: