题目内容
8.实验室需配制一种强酸溶液500mL,c (H+)=2mol/L,下列配制方法可行的是( )| A. | 取100mL5mol/LH2SO4,加入400mL水 | |
| B. | 取200mL5mol/LHCl,加水稀释至500mL | |
| C. | 取200 mL5mol/LH2SO4,加水稀释至500mL | |
| D. | 取100 mL5mol/LHNO3,加水稀释至500mL |
分析 A.加入400mL水,溶液体积不是500mL;
B.稀释前后溶质的物质的量不变;
C.200 mL5mol/LH2SO4中氢离子的物质的量为0.2mL×5mol/L×2=2mol,结合c=$\frac{n}{V}$计算;
D.稀释前后溶质的物质的量不变.
解答 解:A.加入400mL水,溶液体积不是500mL,不能计算稀释后的浓度,故A错误;
B.稀释前后溶质的物质的量不变,则500mL溶液中c (H+)=$\frac{0.2L×5mol/L}{0.5L}$=2mol/L,故B正确;
C.200 mL5mol/LH2SO4中氢离子的物质的量为0.2mL×5mol/L×2=2mol,500mL溶液中c (H+)=$\frac{2mol}{0.5L}$=4mol/L,故C错误;
D.稀释前后溶质的物质的量不变,则500mL溶液中c (H+)=$\frac{0.1L×5mol/L}{0.5}$=1mol/L,故D错误;
故选B.
点评 本题考查溶液配制及物质的量浓度的计算,为高频考点,把握体积、浓度、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意溶液体积的判断,题目难度不大.

练习册系列答案
相关题目
13.用98%的浓硫酸(密度为1.84g•cm-3)配制80mL1mol/L的稀硫酸.现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒⑧80mL容量瓶,按使用仪器的先后顺序,排列正确的是( )
| A. | ④③⑦⑧⑥ | B. | ②③⑦⑤⑥ | C. | ①③⑧⑥⑦ | D. | ②⑥③⑦⑤⑥ |
20.粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④HCl,加入的先后顺序可以是( )
| A. | ①②③④ | B. | ②③①④ | C. | ②①③④ | D. | ③②④① |
17.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在pH=1的溶液中:SO32-、Cl-、NO3-、Na+ | |
| B. | 在能使酚酞变红的溶液中:Na+、Cl-、NO3-、K+ | |
| C. | 在1 mol•L-1的NaAlO2溶液中:K+、Ba2+、SO42-、OH- | |
| D. | 在1 mol•L-1的AlCl3溶液中:NH4+、Ag+、Na+、NO3- |
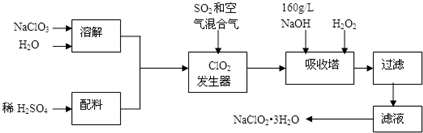
 A是石油裂解主要产物之一,其产量常用于衡量一个石油化工发展水平的标志.
A是石油裂解主要产物之一,其产量常用于衡量一个石油化工发展水平的标志.