题目内容
10.汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-Q kJ/mol(Q>0)实验模拟催化转换器,恒温恒压时用气体传感器测得不同时刻NO和CO的浓度如下表:| 时间/s | 0 | 2 | 3 | 4 | 5 |
| c(NO)/10-3 mol•L-1 | 1.00 | 0.25 | 0.16 | 0.10 | 0.10 |
| c(CO)/10-3 mo l•L-1 | 3.60 | 2.85 | 2.76 | 2.70 | 2.70 |
| A. | 0~2 s间的平均反应速率v(NO)=3.75×10-3mol/(L•s) | |
| B. | 催化转化器对废气的转化速率在冬季时比夏季时高 | |
| C. | 选用更有效的催化剂可以提高污染物的转化率 | |
| D. | 该温度下,此反应的平衡常数K=5.0×103 |
分析 该反应的正反应为放热反应,升高温度不利于平衡向正向移动,反应速率较快,可适用于废气的处理,计算出平衡时各物质的浓度,结合平衡常数表达式可计算平衡常数,以此解答该题.
解答 解:A.0~2 s间的NO的浓度由1.00×10-3 mol•L-1变为0.25×10-3 mol•L-1,平均反应速率v(NO)=$\frac{0.75×1{0}^{-3}mol/L}{2s}$=3.75×10-4mol/(L•s),故A错误;
B.升高温度增大反应速率,转化速率在夏季时比冬季时高,故B错误;
C.催化剂不改变平衡移动,故C错误;
D.2 NO(g)+2CO(g)=N2(g)+2CO2(g)
初始浓度:1.0×10-3 3.6×10-3 0 0
变化浓度:9×10-4 9×10-4 4.5×10-4 9×10-4
平衡浓度:1×10-4 2.7×10-3 4.5×10-4 9×10-4
k=$\frac{4.5×1{0}^{-4}×(9×1{0}^{-4})^{2}}{(1×1{0}^{-4})^{2}(2.7×1{0}^{-3})^{2}}$=5.0×103,故D正确.
故选D.
点评 本题考查化学平衡的调控作用,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握反应的特点以及影响因素的判断,易错点为C,题目难度中等.

练习册系列答案
相关题目
4.下列由相关实验现象所推出的结论正确的是( )
| A. | Cl2、SO2均能品红溶液褪色,说明二者漂白原理相同 | |
| B. | 浓Na2SO4溶液和甲醛都能使蛋白质从溶液中析出,说明二者均使蛋白质发生盐析 | |
| C. | CO2、SO2使澄清石灰水变浑浊,说明二者均为酸性氧化物 | |
| D. | 溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
1.9.6g碳与一定量的氧气在密闭容器中于高温下充分反应后,测得相同条件下的压强是反应前的1.6倍,则原氧气的质量为( )
| A. | 8g | B. | 16g | C. | 24g | D. | 32g |
5.活性炭可用于处理大气污染物NO.在1L密闭容器中加入活性炭和NO,生成N2和气体X.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如表:
判断下列说法正确的是( )
| 活性炭 | NO | N2 | X | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| A. | 气体X的化学式为CO2 | |
| B. | T1℃时的平衡常数K1=$\frac{9}{32}$ | |
| C. | 根据上述信息判断,T1>T2 | |
| D. | T1℃时,向平衡体系中继续加入活性炭,可提高NO的转化率 |
2. 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应:
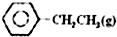 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$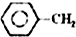 =CH2(g)+H2(g)
=CH2(g)+H2(g)
(1)已知:
计算上述反应的△H=+124KJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数Kp=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
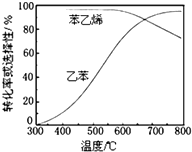
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: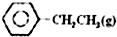 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$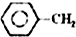 =CH2(g)+H2(g)
=CH2(g)+H2(g)(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数Kp=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
19.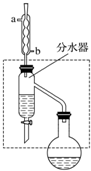 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O
(1)乙酸丁酯粗产品的制备
在干燥的50mL圆底烧瓶中,装入沸石,加入12.0mL正丁醇和16.0mL冰醋酸(过量),再加3~4滴浓硫酸.然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热.将烧瓶中反应后的混合物冷却与分水器的酯层合并.装置中冷水应从b(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是分离生成的水,使平衡正向移动,提高反应产率.
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤.
①正确的操作步骤是C(填标号).
A.①②③④B.③①④②C.④①③②D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是除去产品中含有的乙酸、硫酸等杂质.
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为77.1%.
 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
在干燥的50mL圆底烧瓶中,装入沸石,加入12.0mL正丁醇和16.0mL冰醋酸(过量),再加3~4滴浓硫酸.然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热.将烧瓶中反应后的混合物冷却与分水器的酯层合并.装置中冷水应从b(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是分离生成的水,使平衡正向移动,提高反应产率.
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤.
①正确的操作步骤是C(填标号).
A.①②③④B.③①④②C.④①③②D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是除去产品中含有的乙酸、硫酸等杂质.
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为77.1%.
20.下列说法正确的是( )
| A. | 元素周期表有7个主族,7个副族,1个零族,1个Ⅷ族,共16纵行 | |
| B. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 | |
| C. | Li是最活泼金属,F是最活泼非金属 | |
| D. | NaOH碱性比KOH强 |