题目内容
18.实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放沸石(或碎瓷片);目的是防止暴沸.
(2)反应中加入过量乙醇的目的是提高乙酸的转化率(或提高乙酸乙酯的产率).
分析 (1)加热液体混合物,应放在液体剧烈沸腾;
(2)乙酸乙酯的制备反应为可逆反应,使用过量乙醇利用反应正向移动.
解答 解:(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放沸石(或碎瓷片),目的是防止暴沸,
故答案为:沸石(或碎瓷片); 防止暴沸;
(2)反应中加入过量乙醇的目的是提高乙酸的转化率(或提高乙酸乙酯的产率),
故答案为:提高乙酸的转化率(或提高乙酸乙酯的产率).
点评 本题考查有机物的制备实验评价,为高频考点,把握酯化反应的特点、平衡移动及实验操作为解答的关键,侧重分析与实验能力的考查,注意加热液体易暴沸,题目难度不大.

练习册系列答案
相关题目
20.铝可以制成多种建筑型材,铝在空气中能够稳定存在的原因是( )
| A. | 铝的密度小 | B. | 铝表面能形成致密的氧化膜 | ||
| C. | 常温下铝不能与氧气反应 | D. | 铝的化学性质不活泼 |
10.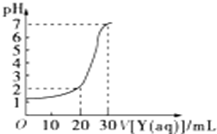 如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
 如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )| A | B | C | D | |
| HCl(mol/L) | 0.12 | 0.04 | 0.09 | 0.12 |
| NaOH(mol/L) | 0.04 | 0.12 | 0.03 | 0.06 |
| A. | A | B. | B | C. | C | D. | D |
5.活性炭可用于处理大气污染物NO.在1L密闭容器中加入活性炭和NO,生成N2和气体X.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如表:
判断下列说法正确的是( )
| 活性炭 | NO | N2 | X | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| A. | 气体X的化学式为CO2 | |
| B. | T1℃时的平衡常数K1=$\frac{9}{32}$ | |
| C. | 根据上述信息判断,T1>T2 | |
| D. | T1℃时,向平衡体系中继续加入活性炭,可提高NO的转化率 |
 可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空: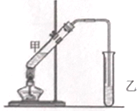 酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如下图所示的装置制取乙酸乙酯.回答下列问题:
酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如下图所示的装置制取乙酸乙酯.回答下列问题: