题目内容
7.下列各种溶液中,Cl-的物质的量浓度与50mL 1mol/L AlCl3溶液中Cl-物质的量浓度相等是( )| A. | 150mL 3mol/LKCl溶液 | B. | 75mL 2mol/LMgCl2溶液 | ||
| C. | 100mL1mol/LNaCl溶液 | D. | 50mL 3mol/LAlCl3溶液 |
分析 溶液中氯离子的物质的量浓度=盐的浓度×化学式中氯离子个数,50mL 1mol•L-1的AlCl3溶液中Cl-物质的量浓度是3mol/L,据此分析解答.
解答 解:50mL 1mol•L-1的AlCl3溶液中Cl-物质的量浓度是3mol/L,
A.150mL 3mol•L-1的KCl溶液中c(Cl-)=3mol•L-1×1=3mol/L;
B.75mL 2mol•L-1的MgCl2溶液中c(Cl-)=2mol•L-1×2=4mol/L;
C.100mL 1mol•L-1的NaCl溶液中c(Cl-)=1mol•L-1×1=1mol/L;
D.50mL 3mol•L-1的AlCl3溶液中c(Cl-)=3mol•L-1×3=9mol/L;
故选A.
点评 本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
17.氯碱工业制备的碱为( )
| A. | NaOH | B. | Na2CO3 | C. | Ca(OH)2 | D. | NaHCO3 |
18.工业制粗硅的反应为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.下列说法正确的是( )
| A. | SiO2为分子晶体,Si为原子晶体 | |
| B. | Si是光导纤维的主要成分 | |
| C. | 在该反应条件下,C的氧化性强于Si的氧化性 | |
| D. | 每生成1 mol Si理论上转移的电子数目约为4×6.02×1023 |
15.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4 L N2和H2混合气中含NA个原子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| B. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| C. | 常温常压下,3.2gO2和3.2gO3中所含氧原子数都是0.2NA | |
| D. | 将常温下含NA个NO2、N2O4分子的混合气体的温度降至标准状况,其体积约为22.4L |
12.下列过程中属于人工固氮的是( )
| A. | 雷雨天气时产生少量NO | |
| B. | 往农田中施放铵态氮肥 | |
| C. | 豆科植物等根部的根瘤菌吸收空气中的氮气转变为氨 | |
| D. | N2和H2在高温、高压和催化剂存在下合成氨 |
19.下列离子方程式不正确的是( )
| A. | 少量碳酸氢铵溶液与足量烧碱溶液混合加热:NH4++OH-$\stackrel{△}{→}$NH3↑+H2O | |
| B. | 氨气通入稀硫酸中:NH3+H+→NH4+ | |
| C. | 稀氨水与稀盐酸混合:NH3?H2O+H+→NH4++H2O | |
| D. | 铜片溶于稀硝酸:3Cu+8H++2NO3-→3Cu2++2NO↑+4H2O |
16.除去下列物质中的杂质(括号中为杂质),所用试剂和方法错误的是( )
| A. | Cu (CuO),加盐酸,过滤 | B. | NaCl (I2)固体,加热升华 | ||
| C. | KNO3 (K2SO4),加BaCl2溶液,过滤 | D. | MgO (Al2O3),加烧碱溶液,过滤 |
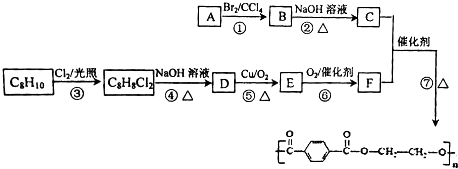
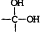 →
→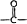 +H2O
+H2O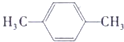 .
.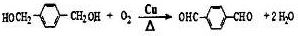 ;
;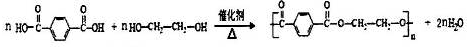 .
.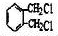 .
.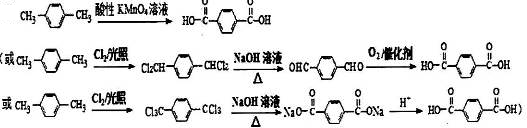 (有机物用结构简式表示,无机试剂任选).
(有机物用结构简式表示,无机试剂任选).