题目内容
16.除去下列物质中的杂质(括号中为杂质),所用试剂和方法错误的是( )| A. | Cu (CuO),加盐酸,过滤 | B. | NaCl (I2)固体,加热升华 | ||
| C. | KNO3 (K2SO4),加BaCl2溶液,过滤 | D. | MgO (Al2O3),加烧碱溶液,过滤 |
分析 A.CuO可与盐酸反应;
B.碘易升华;
C.生成KCl,引入新杂质;
D.氧化铝可与氢氧化钠溶液反应.
解答 解:A.CuO可与盐酸反应,而铜不反应,可用于除杂,故A正确;
B.碘易升华,可用于除杂,故B正确;
C.生成KCl,引入新杂质,应用硝酸钡除杂,故C错误;
D.氧化铝可与氢氧化钠溶液反应,可用于除杂,故D正确.
故选C.
点评 本题考查物质的分离提纯,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,除杂时不能引入新杂质,更不能影响被提纯物质的性质,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列各种溶液中,Cl-的物质的量浓度与50mL 1mol/L AlCl3溶液中Cl-物质的量浓度相等是( )
| A. | 150mL 3mol/LKCl溶液 | B. | 75mL 2mol/LMgCl2溶液 | ||
| C. | 100mL1mol/LNaCl溶液 | D. | 50mL 3mol/LAlCl3溶液 |
4.从某些性质来看,NH3和H2O、NH4+和H+、NH2-和OH-、N3-和O2-两两类似.据此判断,下列反应中正确的是( )
①NH4Cl+NaNH2$\stackrel{△}{→}$NaCl+2NH3↑
②CaO+2NH4Cl$\stackrel{△}{→}$CaCl2+2NH3↑+H2O
③3Mg(NH2)2$\stackrel{△}{→}$Mg3N2+4NH3↑
①NH4Cl+NaNH2$\stackrel{△}{→}$NaCl+2NH3↑
②CaO+2NH4Cl$\stackrel{△}{→}$CaCl2+2NH3↑+H2O
③3Mg(NH2)2$\stackrel{△}{→}$Mg3N2+4NH3↑
| A. | 仅①正确 | B. | ②③正确 | C. | ①③正确 | D. | 全部正确 |
8.现有部分元素的性质与原子(或分子)结构如表所示:
(1)写出元素T的离子结构示意图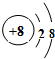 .
.
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)由T、X、Y共同形成既有离子键又有共价键的化合物,写出该化合物的电子式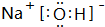 .
.
(4)Z的氧化物和Y 的最高价氧化物的水化物反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 周期表中原子半径最小的元素 |
| T | 最外层电子数是次外层电子数的3倍 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
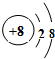 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)由T、X、Y共同形成既有离子键又有共价键的化合物,写出该化合物的电子式
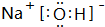 .
.(4)Z的氧化物和Y 的最高价氧化物的水化物反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
6.短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D、C和E分别同主族.A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说确的是( )
| A. | 原子半径D>E>C>B | |
| B. | A、C、D、E四种元素形成的化合物溶于水一定显酸性 | |
| C. | C、D形成的化合物是离子化合物,只含有离子键 | |
| D. | A、C形成的化合物只有氧化性没有还原性 |

 RCH2COOH$→_{红磷}^{Br_{2}}$
RCH2COOH$→_{红磷}^{Br_{2}}$ 请以2一甲基丙醇和甲醇为原料,设计制备有
请以2一甲基丙醇和甲醇为原料,设计制备有