题目内容
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| B. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| C. | 常温常压下,3.2gO2和3.2gO3中所含氧原子数都是0.2NA | |
| D. | 将常温下含NA个NO2、N2O4分子的混合气体的温度降至标准状况,其体积约为22.4L |
分析 A、过氧化钠与水的反应中,氧元素的价态由-1价变为0价;
B、氢氧燃料电池中,正极上消耗的是氧气;
C、氧气和臭氧分子均由氧原子构成;
D、NO2气体中存在平衡:2NO2?N2O4,正反应放热.
解答 解:A、过氧化钠与水的反应中,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时,转移0.2mol电子即0.2NA个,故A错误;
B、氢氧燃料电池中,正极上消耗的是氧气,且反应后变为-2价,故当正极消耗22.4L氧气即1mol氧气时,转移4mol电子即4NA个,故B错误;
C、氧气和臭氧分子均由氧原子构成,故3.2g氧气和3.2g臭氧中含有的氧原子的物质的量均为n=$\frac{3.2g}{16g/mol}$=0.2mol,故含0.2NA个,故C正确;
D、NO2气体中存在平衡:2NO2?N2O4,正反应放热,故将常温下含NA个NO2、N2O4分子的混合气体的温度降至标准状况,平衡右移,分子数小于NA个,则体积小于22.4L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
12.纯碱属于( )
| A. | 氧化物 | B. | 酸 | C. | 碱 | D. | 盐 |
13. 锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:
锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:
2NH4++2e-=2NH3↑+H2↑.电池总反应为:2MnO2(s)+Zn(s)+NH4+(aq)=2MnO(OH)(s)+[Zn(NH3)2]2+(aq).
请回答下列问题:
(1)电池的负极反应式为Zn+2NH4+-2e-=[Zn(NH3)2]2++2H+.
(2)对干电池不能进行加热或充电,否则会有可能发生爆炸.
(3)废电池糊状填充物经溶解、过滤,得到无色滤液和黑色滤渣.某课外活动小组对该滤液和滤渣进行了探究.已知:滤液的成份是氯化锌和氯化铵;Zn(OH)2是两性氢氧化物.
I.取少量滤液于试管中,滴入适量NaOH溶液产生白色沉淀至沉淀刚开始溶解,并字不要微热,生成无色刺激性气体,检验该气体的方法是将湿润的红色石蕊试纸靠近试管口,试纸变蓝.继续往试管中滴入FeCl3溶液,白色沉淀部分转化为红褐色沉淀,则可判断Zn(OH)2的Ksp大于Fe(OH)3的Ksp(填“大于”、“小于”、“不能判断”),写出该反应的离子方程式3Zn(OH)2 (s)+2Fe3+(aq)=2Fe(OH)3(s)+3Zn2+(aq).
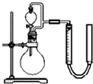
II.从黑色滤渣分离出二氧化锰,探究其在用H2O2制备O2过程中的作用.实验装置如图所示,将等量的H2O2溶液加入烧瓶中,分别进行2次实验(气体体积在相同条件下测定).
为了准确读取量气管读数,读数时视线应与左管凹液面最低处相平,还应注意读数前上下移动右管,使两管液面保持同一高度,实验1中MnO2的作用是催化剂,则实验2中反应的离子方程式为H2O2+2H++MnO2=Mn2++2H2O+O2↑.
(4)用废电池的锌皮制作七水合硫酸锌(含少量金属铁),其流程如下:
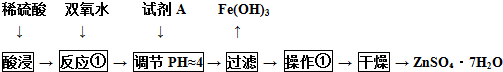
试剂A是ZnO(填化学式),操作①包括蒸发浓缩、冷却结晶、过滤、洗涤等操作,其过程中所需的仪器有酒精灯、玻璃棒、漏斗和下列仪器中的bd(填字母).(铁架台及夹持仪器略)
a.坩埚 b.蒸发皿 c.圆底烧瓶 d.小烧杯
(5)ZnSO4•7H2O晶体溶解于饱和Na2CO3溶液中,得到6.46g的碱式碳酸锌[Znx(CO3)y(OH)z],为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式Zn3(CO3)(OH)4.
 锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:
锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:2NH4++2e-=2NH3↑+H2↑.电池总反应为:2MnO2(s)+Zn(s)+NH4+(aq)=2MnO(OH)(s)+[Zn(NH3)2]2+(aq).
请回答下列问题:
(1)电池的负极反应式为Zn+2NH4+-2e-=[Zn(NH3)2]2++2H+.
(2)对干电池不能进行加热或充电,否则会有可能发生爆炸.
(3)废电池糊状填充物经溶解、过滤,得到无色滤液和黑色滤渣.某课外活动小组对该滤液和滤渣进行了探究.已知:滤液的成份是氯化锌和氯化铵;Zn(OH)2是两性氢氧化物.
I.取少量滤液于试管中,滴入适量NaOH溶液产生白色沉淀至沉淀刚开始溶解,并字不要微热,生成无色刺激性气体,检验该气体的方法是将湿润的红色石蕊试纸靠近试管口,试纸变蓝.继续往试管中滴入FeCl3溶液,白色沉淀部分转化为红褐色沉淀,则可判断Zn(OH)2的Ksp大于Fe(OH)3的Ksp(填“大于”、“小于”、“不能判断”),写出该反应的离子方程式3Zn(OH)2 (s)+2Fe3+(aq)=2Fe(OH)3(s)+3Zn2+(aq).
II.从黑色滤渣分离出二氧化锰,探究其在用H2O2制备O2过程中的作用.实验装置如图所示,将等量的H2O2溶液加入烧瓶中,分别进行2次实验(气体体积在相同条件下测定).
| 序号 | 烧瓶中的物质 | 气体体积 | MnO2的作用 |
| 实验1 | 足量MnO2 | 56mL | |
| 实验2 | 足量MnO2和稀硫酸 | 112mL |
(4)用废电池的锌皮制作七水合硫酸锌(含少量金属铁),其流程如下:

试剂A是ZnO(填化学式),操作①包括蒸发浓缩、冷却结晶、过滤、洗涤等操作,其过程中所需的仪器有酒精灯、玻璃棒、漏斗和下列仪器中的bd(填字母).(铁架台及夹持仪器略)
a.坩埚 b.蒸发皿 c.圆底烧瓶 d.小烧杯
(5)ZnSO4•7H2O晶体溶解于饱和Na2CO3溶液中,得到6.46g的碱式碳酸锌[Znx(CO3)y(OH)z],为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式Zn3(CO3)(OH)4.
10.在体积一定的密闭容器中1mol N2和3mol H2发生反应:N2+3H2?催化剂高温高压2NH3.下列有关说法正确的是( )
| A. | 降低温度可以加快反应速率 | |
| B. | 向容器中再加入N2可以加快反应速率 | |
| C. | 达到化学反应限度时,生成2 mol NH3 | |
| D. | 达到化学平衡时 N2、H2、NH3的物质的量之比为1:3:2 |
17.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 高温或日常用的消毒剂可使禽流感病毒蛋白质变性 | |
| C. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 | |
| D. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
7.下列各种溶液中,Cl-的物质的量浓度与50mL 1mol/L AlCl3溶液中Cl-物质的量浓度相等是( )
| A. | 150mL 3mol/LKCl溶液 | B. | 75mL 2mol/LMgCl2溶液 | ||
| C. | 100mL1mol/LNaCl溶液 | D. | 50mL 3mol/LAlCl3溶液 |
14.下列有关物质的保存方法正确的是( )
| A. | 浓硝酸保存在棕色带橡胶塞的试剂瓶中 | |
| B. | 漂粉精露置在空气中 | |
| C. | 烧碱溶液可保存在带玻璃塞试剂瓶中 | |
| D. | 可用铝制容器存放浓硫酸 |
12.NA为阿伏伽德罗常数的值.下列说法错误的是( )
| A. | 等质量的H2O与CH2D2含有的质子数相同 | |
| B. | 室温下CH3COONH4溶液pH=7,1L 0.1mol•L-1该溶液中NH4+离子数为0.1NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数为0.2NA | |
| D. | 1mol CH3COOC2H5在足量NaOH溶液中水解得到乙醇分子数为NA |