题目内容
6.一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )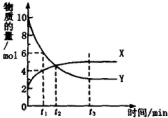
| A. | 反应的化学方程式为5Y?X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等,达到化学平衡 | |
| D. | t3时,逆反应速率大于正反应速率 |
分析 达到平衡时,Y的物质的量为3mol,变化量为10mol-3mol=7mol,X的物质的量为5mol,变化量为5mol-2mol=3mol,反应的方程式为7Y?3X,结合图象解答该题.
解答 解:A、达到平衡时,Y的物质的量为3mol,变化量为10mol-3mol=7mol,X的物质的量为5mol,变化量为5mol-2mol=3mol,反应的方程式为7Y?3X,故A错误;
B、t1时,Y的物质的量为6mol,X的物质的量为4mol,物质的量之比等于浓度之比,则Y的浓度是X浓度的1.5倍,故B正确;
C、由图可知t2时,反应没有达到平衡,此时反应继续向正方向移动,正反应速率大于逆反应速率,故C错误;
D、由图可知t3时,反应达到平衡,正逆反应速率相等且不再变化,故D错误;
故选:B.
点评 本题考查化学反应速率与化学平衡知识,做题时注意从反应物和生成物的物质的量的变化角度,判断反应物和生成物以及反应是否达到平衡,难度中等.

练习册系列答案
相关题目
16.下列有关维生素C的说法中,正确的是( )
| A. | 如果人体缺少维生素C,易患夜盲症、干眼症等眼疾 | |
| B. | 维生素C属于脂溶性维生素,主要存在于新鲜水果和蔬菜中 | |
| C. | 维生素C具有较强的还原性,能使酸性高锰酸钾溶液褪色 | |
| D. | 富含维生素C的食物应在高温下烹调,才能充分提高维生素C的功能 |
17.关于如图各实验装置的叙述中,不正确的是( )
| A. |  可用于分离苯和水的混合物 | |
| B. |  可用于收集H2、NH3、CO2、Cl2、HCl等气体 | |
| C. |  X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 | |
| D. | 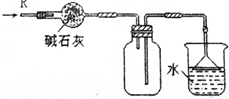 可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
14.表为元素周期表的一部分.
回答下列问题
(1)Z元素在周期表中的位置为第三周期,第ⅤⅡA族.
(2)表中元素的原子半径最大的是(填元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成8.5gX的最高价化合物,恢复至室温,放热34.35kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(5)碳与铝形成的1mol化合物Q与水反应,生成4molAl(OH)3和3mol化合物L(仅含碳、氢两种元素),则L的电子式为 .
.
(6)H2Y2是实验室中的常用试剂,其结构中存在的共价键有和,在制备过程中要防止Fe3+的混入,理由是铁离子对过氧化氢分解起到催化剂作用,.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期,第ⅤⅡA族.
(2)表中元素的原子半径最大的是(填元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成8.5gX的最高价化合物,恢复至室温,放热34.35kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(5)碳与铝形成的1mol化合物Q与水反应,生成4molAl(OH)3和3mol化合物L(仅含碳、氢两种元素),则L的电子式为
 .
.(6)H2Y2是实验室中的常用试剂,其结构中存在的共价键有和,在制备过程中要防止Fe3+的混入,理由是铁离子对过氧化氢分解起到催化剂作用,.
1.几种短周期元素的原子半径及主要化合价见下表:
下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、R 的单质与稀盐酸反应速率 L<R | |
| B. | L 与 T 形成的化合物具有两性 | |
| C. | Q、T 两元素的氢化物热稳定性 Q<T | |
| D. | L、Q 形成的简单离子核外电子数相等 |
11.如图是某同学画的氮元素基态原子核外电子排布图,该电子排布图违背了下列哪个原理( )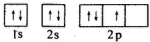

| A. | 洪特规则 | B. | 泡利原理 | C. | 能量最低原理 | D. | 洪特规则特例 |
18.用下列实验装置进行相应实验能达到目的是( )
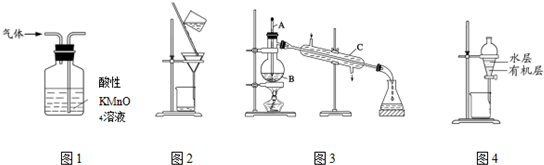

| A. | 用图1所示装置可除去甲烷中乙烯杂质 | |
| B. | 用图2所示装置分离硫酸铜溶液和铜 | |
| C. | 用图3所示装置分离乙醇和水 | |
| D. | 用图4所示装置分离苯萃取碘水后已分层的有机层和水层 |