题目内容
17.关于如图各实验装置的叙述中,不正确的是( )| A. | 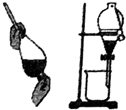 可用于分离苯和水的混合物 | |
| B. | 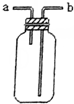 可用于收集H2、NH3、CO2、Cl2、HCl等气体 | |
| C. | 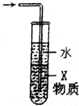 X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 | |
| D. | 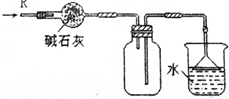 可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
分析 A.苯和水的混合物分层;
B.a进气可收集密度比空气密度小的气体,b进气可收集密度比空气密度大的气体;
C.X若为四氯化碳,可隔绝气体和水;
D.HCl与碱石灰反应,且密度比空气的密度大.
解答 解:A.苯和水的混合物分层,则可利用分液漏斗分离,故A正确;
B.a进气可收集H2、NH3等气体,b进气可收集CO2、Cl2、HCl等气体,故B正确;
C.X若为四氯化碳,可隔绝气体和水,则可用于吸收氨气或氯化氢,并防止倒吸,故C正确;
D.HCl与碱石灰反应,且密度比空气的密度大,则干燥及收集均不合理,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离方法、气体的收集及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
7.下列反应属于加成反应的是( )
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | B. |  | ||
| C. |  | D. | HCl+AgNO3═AgCl↓?+HNO3 |
8.已知锌与稀盐酸反应放热.某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气.所用稀盐酸浓度有1.00mol•L-1、2.00mol•L-1两种浓度,每次实验稀盐酸的用量为25.00mL,锌有细颗粒与粗颗粒两种规格,用量为6.50g.实验温度为298K、308K.
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
(2)实验①记录如下(换算成标况):
①计算在30s~40s范围内盐酸的平均反应速率ν(HCl)=0.056mol•L-1•s-1.(忽略溶液体积变化,不需要写出计算过程).
②反应速率最大的时间段(即0s~10s、10s~20s、20s~30s、30s~40s…)为40s~50s,可能原因是反应放热.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.氨水 B.CuCl2溶液 C.NaCl溶液 D.KNO3溶液
你认为他上述做法中可行的是C(填相应字母);
(4)另有某温度时,在2L容器中X、Y、Z物质的量随时间的变化关系曲线如下图1所示,该反应的化学方程式为:3X+Y?2Z.

(5)在化学反应速率的学习中,某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图2甲可通过观察生成气泡的快慢判断,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子不同造成的干扰.
②定量分析:如图2乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是收集40mL气体所需要的时间.
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(即0s~10s、10s~20s、20s~30s、30s~40s…)为40s~50s,可能原因是反应放热.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.氨水 B.CuCl2溶液 C.NaCl溶液 D.KNO3溶液
你认为他上述做法中可行的是C(填相应字母);
(4)另有某温度时,在2L容器中X、Y、Z物质的量随时间的变化关系曲线如下图1所示,该反应的化学方程式为:3X+Y?2Z.

(5)在化学反应速率的学习中,某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图2甲可通过观察生成气泡的快慢判断,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子不同造成的干扰.
②定量分析:如图2乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是收集40mL气体所需要的时间.
5.有四种化合物:①NaHCO3、②Al(OH)3、③(NH4)2S、④H2NCH2COOH,跟盐酸和氢氧化钠溶液都能反应的是( )
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
12.下列说法正确的是( )
| A. | 糖类化合物都具有相同的官能团 | |
| B. | 糖类是提供能量最高的营养物质 | |
| C. | 蛋白质的水解产物都含有羧基和氨基 | |
| D. | 酯类在碱性条件下的水解反应称为皂化反应 |
2.某研究性学习小组以酸性KMnO4溶液和草酸(H2C2O4,二元弱酸)溶液为例,研究影响化学反应速率的因素,设计如表方案:
(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)实验的记时方法是从溶液混合开始记时,至紫红色刚好褪去时,记时结束.
(3)实验①和②研究浓度对反应速率的影响,则V1=5.0mL,V2=3.0mL.
(4)下列有关该实验的叙述正确的是C、D.
A.实验时不能用量筒来量取液体的体积
B.实验时应将5.0mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数.
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(5)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是反应生成的Mn2+对反应有催化作用.
| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
(2)实验的记时方法是从溶液混合开始记时,至紫红色刚好褪去时,记时结束.
(3)实验①和②研究浓度对反应速率的影响,则V1=5.0mL,V2=3.0mL.
(4)下列有关该实验的叙述正确的是C、D.
A.实验时不能用量筒来量取液体的体积
B.实验时应将5.0mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数.
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(5)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是反应生成的Mn2+对反应有催化作用.
9.“绿色化学”是21世纪化学发展的主要方向.“绿色化学”要求从根本上消除污染,它包括“原料的绿色化”、“化学反应的绿色化”、“产物的绿色化”等内容.其中“化学反应的绿色化”要求反应物中所有的原子完全被利用且全部转入期望的产品中.下列符合“化学反应的绿色化”的是( )
| A. | SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | NO2+NO+2NaOH═2NaNO2+H2O | |
| C. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O | |
| D. | CuO+H2SO4(稀)═CuSO4+H2O |
6.一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )

| A. | 反应的化学方程式为5Y?X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等,达到化学平衡 | |
| D. | t3时,逆反应速率大于正反应速率 |