题目内容
16.下列有关维生素C的说法中,正确的是( )| A. | 如果人体缺少维生素C,易患夜盲症、干眼症等眼疾 | |
| B. | 维生素C属于脂溶性维生素,主要存在于新鲜水果和蔬菜中 | |
| C. | 维生素C具有较强的还原性,能使酸性高锰酸钾溶液褪色 | |
| D. | 富含维生素C的食物应在高温下烹调,才能充分提高维生素C的功能 |
分析 A、缺少维生素A易患夜盲症、干眼症;
B、维生素C属于水溶性维生素;
C、维生素C极易被氧化;
D、高温条件下,维生素C更易被氧化.
解答 解:A、缺少维生素A易患夜盲症、干眼症,缺乏维生素C易患败血症,故A错误;
B、维生素C属于水溶性维生素,不是脂溶性,主要存在于新鲜的水果和蔬菜中,故B错误;
C、维生素C极易被氧化,有很强的还原性,故能被高锰酸钾溶液氧化,从而使高锰酸钾溶液褪色,故C正确;
D、高温条件下,维生素C更易被氧化,故富含维生素C的食物不应在高温下烹调,且应快速烹调以减少损失,故D错误.
故选C.
点评 本题考查了维生素C的性质和在生活中的应用常识,难度不大,应注意维生素C有强还原性这一性质.

练习册系列答案
相关题目
6.随着科学技术的发展,新材料层出不穷.下列属于金属材料的是( )
| A. | 生物陶瓷 | B. | 钢化玻璃 | C. | 钛合金 | D. | 聚四氟乙烯 |
7.下列反应属于加成反应的是( )
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | B. | 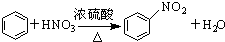 | ||
| C. | 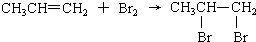 | D. | HCl+AgNO3═AgCl↓?+HNO3 |
11.一定温度下,固定容器的密闭容器中进行的可逆反应:A(g)+B(g)?C(g)+D(g),当下列物理量不再改变时,表明反应已达到平衡的是( )
| A. | 单位时间内有1mol A生成,有1molC消耗 | |
| B. | 混合气体的密度不变 | |
| C. | A的消耗速率与D的消耗速率相同 | |
| D. | 混合物的平均相对分子质量不变 |
1.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6 g丙烷中所含的极性共价键为4NA个 | |
| D. | 在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA |
8.已知锌与稀盐酸反应放热.某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气.所用稀盐酸浓度有1.00mol•L-1、2.00mol•L-1两种浓度,每次实验稀盐酸的用量为25.00mL,锌有细颗粒与粗颗粒两种规格,用量为6.50g.实验温度为298K、308K.
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
(2)实验①记录如下(换算成标况):
①计算在30s~40s范围内盐酸的平均反应速率ν(HCl)=0.056mol•L-1•s-1.(忽略溶液体积变化,不需要写出计算过程).
②反应速率最大的时间段(即0s~10s、10s~20s、20s~30s、30s~40s…)为40s~50s,可能原因是反应放热.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.氨水 B.CuCl2溶液 C.NaCl溶液 D.KNO3溶液
你认为他上述做法中可行的是C(填相应字母);
(4)另有某温度时,在2L容器中X、Y、Z物质的量随时间的变化关系曲线如下图1所示,该反应的化学方程式为:3X+Y?2Z.
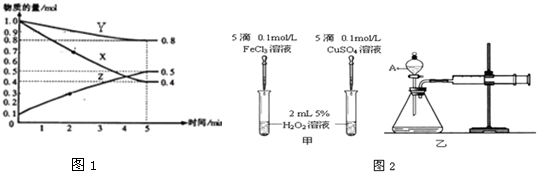
(5)在化学反应速率的学习中,某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图2甲可通过观察生成气泡的快慢判断,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子不同造成的干扰.
②定量分析:如图2乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是收集40mL气体所需要的时间.
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(即0s~10s、10s~20s、20s~30s、30s~40s…)为40s~50s,可能原因是反应放热.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.氨水 B.CuCl2溶液 C.NaCl溶液 D.KNO3溶液
你认为他上述做法中可行的是C(填相应字母);
(4)另有某温度时,在2L容器中X、Y、Z物质的量随时间的变化关系曲线如下图1所示,该反应的化学方程式为:3X+Y?2Z.

(5)在化学反应速率的学习中,某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图2甲可通过观察生成气泡的快慢判断,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子不同造成的干扰.
②定量分析:如图2乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是收集40mL气体所需要的时间.
5.有四种化合物:①NaHCO3、②Al(OH)3、③(NH4)2S、④H2NCH2COOH,跟盐酸和氢氧化钠溶液都能反应的是( )
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
6.一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )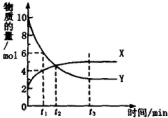

| A. | 反应的化学方程式为5Y?X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等,达到化学平衡 | |
| D. | t3时,逆反应速率大于正反应速率 |