题目内容
16.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 25°C,pH=2的HCl溶液中含有H+的数目为0.01NA | |
| B. | 1mol$NH_4^+$中含有10NA个质子 | |
| C. | 1mol碳烯(:CH2)中含有的电子数8NA | |
| D. | 5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
分析 A、溶液体积不明确;
B、铵根离子中含11个质子;
C、碳烯中含8个电子;
D、铁和硝酸反应后最终可能变为+3价,还可能变为+2价.
解答 解:A、溶液体积不明确,故溶液中的氢离子的个数无法计算,故A错误;
B、铵根离子中含11个质子,故1mol铵根离子中含11NA个质子,故B错误;
C、碳烯中含8个电子,故1mol碳烯中含8NA个电子,故C正确;
D、铁和硝酸反应后最终可能变为+3价,还可能变为+2价,故5.6g铁粉即0.1mol铁粉和硝酸反应后失去的电子可能为0.3NA个,还可能为0.2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目
7.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2L NH3所含的原子数为2NA | |
| B. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L H2中所含原子数为NA | |
| D. | 标准状况下,22.4L H2O中所含分子数为NA |
4.用离子方程式解释以下指定反应,书写正确的是( )
| A. | 亚硫酸钠溶液显碱性:SO32-+2H2O=H2SO3+2OH- | |
| B. | (NH4)2FeSO4溶液与过量NaOH溶液混合制取氢氧化亚铁:Fe2++2OH-=Fe(OH)2 | |
| C. | NaAlO2溶液中通入过量CO2制取氢氧化铝:2AlO2-+CO2+3H2O=2Al(OH)3+CO32- | |
| D. | 铁红溶于HI酸溶液:Fe2O3+6H++2I-=2Fe2++I2+3H2O |
11.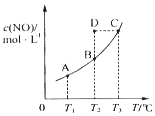 在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
 在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB | |
| D. | 在T2时,若 反 应 体 系 处于 状 态D,则 此 时 v正>v逆 |
1.在一个绝热的固定容积的密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g);△H<0,下列各项中不能说明该反应已经达到平衡状态的是( )
| A. | 体系的压强不再改变 | |
| B. | 体系的温度不再改变 | |
| C. | 消耗1molN2的同时,新生成3molH2 | |
| D. | 反应消耗的N2、H2与产生的NH3的速率υ(N2):υ(H2):υ(NH3)═1:3:2 |
8.下列说法正确的是( )
| A. | 氮气的化学性质不活泼,是因为氮元素不活泼 | |
| B. | 雷雨可以增加土壤中硝酸盐类氮肥的含量,此过程中的反应都属于氮的固定 | |
| C. | 氮气可替代稀有气体作焊接金属的保护气 | |
| D. | NO2溶于水生成硝酸,因此NO2是硝酸的酸酐 |
5.某化学兴趣趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
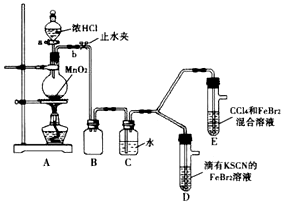
(1)①A装置中圆底烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↓+2H2O;
②检查气体发生装置 A的气密性的操作是:关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好.
③装置B的作用是安全瓶,防止液体倒吸
(2)整套实验装置存在一处明显不足,请指出缺少尾气处理装置.
用改正后的装置进行实验.实验过程如表:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化:
D装置中:红色慢慢褪去
E装置中:CCl4层先由无色变为橙色,后颜色逐渐变成红色.
为探究上述实验现象的本质,小组同学查得资料如表:
①请用平衡移动原理(结合化学用语) 解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色.
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生,请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应产生Cl-,没有Br-生成,由于AgBrO易溶于水,加入AgNO3溶液,只能生成AgCl沉淀.

(1)①A装置中圆底烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↓+2H2O;
②检查气体发生装置 A的气密性的操作是:关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好.
③装置B的作用是安全瓶,防止液体倒吸
(2)整套实验装置存在一处明显不足,请指出缺少尾气处理装置.
用改正后的装置进行实验.实验过程如表:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适置浓盐酸,然后关闭活塞a,点燃酒精灯 | D装罝中:溶液变红,E装置中:水层溶液变黄,振荡后CCl4层无明显变化 | Cl2、Br2、Fe2+的氧化性由强到弱的顺序为Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去
E装置中:CCl4层先由无色变为橙色,后颜色逐渐变成红色.
为探究上述实验现象的本质,小组同学查得资料如表:
| i.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2 ii.Cl2和Br2反应生成BrCl,它呈红色(略带黄色)沸点约为5℃,与水发生水解反应 iii.AgClO、AgBrO均可溶于水 |
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生,请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应产生Cl-,没有Br-生成,由于AgBrO易溶于水,加入AgNO3溶液,只能生成AgCl沉淀.



