题目内容
5.某化学兴趣趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验: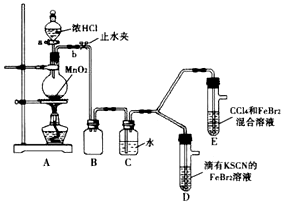
(1)①A装置中圆底烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↓+2H2O;
②检查气体发生装置 A的气密性的操作是:关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好.
③装置B的作用是安全瓶,防止液体倒吸
(2)整套实验装置存在一处明显不足,请指出缺少尾气处理装置.
用改正后的装置进行实验.实验过程如表:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适置浓盐酸,然后关闭活塞a,点燃酒精灯 | D装罝中:溶液变红,E装置中:水层溶液变黄,振荡后CCl4层无明显变化 | Cl2、Br2、Fe2+的氧化性由强到弱的顺序为Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去
E装置中:CCl4层先由无色变为橙色,后颜色逐渐变成红色.
为探究上述实验现象的本质,小组同学查得资料如表:
| i.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2 ii.Cl2和Br2反应生成BrCl,它呈红色(略带黄色)沸点约为5℃,与水发生水解反应 iii.AgClO、AgBrO均可溶于水 |
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生,请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应产生Cl-,没有Br-生成,由于AgBrO易溶于水,加入AgNO3溶液,只能生成AgCl沉淀.
分析 (1)①A装置中圆底烧瓶中二氧化锰和浓盐酸反应生成氯化锰、氯气和水;
②装置A制备氯气,装置连接后应检验装置的气密性,可以利用分液漏斗中的液体是否流下分析判断装置气密性;
③装置B的作用是防止倒吸;
(2)氯气有毒不能直接排空,要用碱液吸收尾气;自发进行的同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(3)①过量氯气和SCN-反应SCN-浓度减小,根据铁离子和硫氰根离子反应平衡原理分析;
②氯化溴能发生水解反应生成酸,根据AgBrO、AgCl的溶解性分析.
解答 解:(1)①A装置中圆底烧瓶中二氧化锰和浓盐酸反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↓+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↓+2H2O;
②装置A制备氯气,装置连接后应检验装置的气密性,方法是关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好,
故答案为:关闭止水夹b,打开活塞a;
③装置B的作用是做安全瓶,防止倒吸,故答案为:安全瓶,防止液体倒吸;
(2)由于氯气有毒,直接排放到空气中会污染大气,要用碱液吸收尾气,实验装置缺少尾气处理装置;D装置中:溶液变红,说明有铁离子生成,据此得出氯气的氧化性大于铁离子;E装置中:水层溶液变黄,振荡后CCl4层无明显变化,说明氯气和溴离子不反应,根据D和E装置知,溴的氧化性大于铁离子,则氧化性强弱顺序是 Cl2>Br2>Fe3+,故答案为:缺少尾气处理装置;Cl2>Br2>Fe3+;
(3)①过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色,
为检验其褪色原因,检验方法为:取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理;或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理,
故答案为:过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色;
②过量的氯气和溴反应生成氯化溴,氯化溴不稳定,易和水反应生成盐酸和次溴酸,氯离子和银离子反应生成白色沉淀氯化银,次溴酸和银离子反应生成次溴酸银易溶于水,所以生成的白色沉淀为氯化银,
故答案为:BrCl+H2O=HBrO+HCl反应产生Cl-,没有Br-生成,由于AgBrO易溶于水,加入AgNO3溶液,只能生成AgCl沉淀.
点评 本题考查了性质实验方案设计,明确反应原理是解本题关键,结合资料分析解答,会根据离子反应方程式判断氧化性强弱,会根据实验现象确定发生的反应,难度中等.

| A. | 1molCa变成Ca2+时失去的电子数为NA | |
| B. | 同温、同压、同体积的CO和NO含有的质子数 | |
| C. | 标准状况下22.4L以任意比例混合的氢气和氧气所含分子总数均为NA | |
| D. | 常温常压下,16g氧气和臭氧(O3)的混合气体中含有NA个氧原子 |
| A. | 25°C,pH=2的HCl溶液中含有H+的数目为0.01NA | |
| B. | 1mol$NH_4^+$中含有10NA个质子 | |
| C. | 1mol碳烯(:CH2)中含有的电子数8NA | |
| D. | 5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
| A. | CaCO3 | B. | BaCO3 | C. | MgCO3 | D. | SrCO3 |
| A. | 镁离子的结构示意图: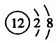 | B. | 苯甲酸乙酯的结构简式: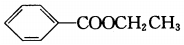 | ||
| C. | CO2的电子式: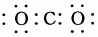 | D. | 中子数为18的氯原子:${\;}_{17}^{18}$Cl |
| A. | 纯碱和烧碱都属于碱 | |
| B. | 凡是能电离出H+的化合物都叫做酸 | |
| C. | 铝片在空气中能剧烈燃烧并放出大量的热 | |
| D. | NH3的水溶液可以导电,但NH3属于非电解质 |
| A. | CO的浓度保持恒定 | B. | 混合气体的平均分子量逐渐减少 | ||
| C. | CO和NO的物质的量之比逐渐增大 | D. | v(CO):v(NO):v(N2)=2:2:1 |
| A. | 含有阴离子的化合物一定含有阳离子 | |
| B. | CS2、H2O、C2H2都是直线型分子 | |
| C. | 离子化合物的熔点一定比共价化合物的高 | |
| D. | 酸性:H3PO4>H2SO4>HClO4 |
 表所列物质或概念间的从属关系符合如图所示关系的是( )
表所列物质或概念间的从属关系符合如图所示关系的是( )