题目内容
10.已知氢化锂(LiH)属于离子化合物,LiH跟水反应可以放出氢气.下列叙述中正确的是( )| A. | LiH跟水反应后的溶液显中性 | B. | LiH在化学反应中是一种强氧化剂 | ||
| C. | LiH中氢离子可以被还原成氢气 | D. | LiH中氢离子半径比锂离子半径大 |
分析 在离子化合物LiH中,Li+与H-以离子键结合而成,该物质溶于水生成H2,可以想到H-与水中的H+之间发生氧化还原反应,除生成H2外,另一产物应是LiOH,所以对该反应的分析可根据下列几点:①属于氧化还原反应;②LiH是还原剂,H2O是氧化剂;③所得溶液是LiOH碱性溶液.
解答 解:A、LiH跟水反应的方程式为LiH+H2O=H2↑+LiOH,溶液呈碱性,故A错误;
B、LiH+H2O=H2↑+LiOH反应中,LiH是还原剂,H2O是氧化剂,故B错误;
C、在离子化合物LiH中,Li+与H-以离子键结合而成,H-与水中的H+之间发生氧化还原反应而被氧化,故C错误;
D、LiH中氢离子与锂离子核外电子排布相同,核电核数越小,半径越大,则LiH中氢离子比锂离子的半径大,故D正确.
故选:D.
点评 本题考查氧化还原反应,题目难度不大,注意从化合价的角度分析物质的性质.

练习册系列答案
相关题目
6.根据图回答,下列说法错误的是( )
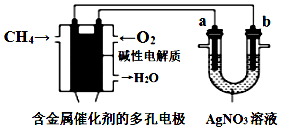

| A. | 电子经导线流入b电极 | |
| B. | 若b极增重5.4 g时,燃料电池负极消耗CH4的体积为140 mL | |
| C. | 燃料电池中正极反应为O2+4e-+2H2O═4OH- | |
| D. | 此装置用于电镀银时,一段时间后硝酸银溶液的浓度不变 |
1.运用化学反应原理研究碳、氮、硫元素及其化合物有重要意义.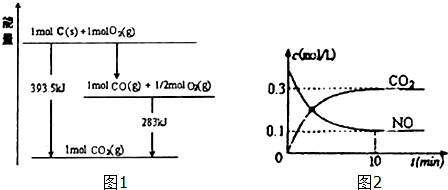
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:
写出CO2(g)与C(s)反应生成CO(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(2)汽车尾气净化过程中发生反应2NO(g)+2CO(g)?N2+2CO2(g)△H<0.一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L,(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图2所示曲线.
①下列关于上述反应过程的叙述正确的是AD(填写字母代号).
A.其它条件不变,加入催化剂,△H的值不变
B.及时除去二氧化碳,反应的正反应速率加快
C.NO、CO、N2、CO2浓度均不再变化,说明未达到平衡状态
D.混合气体的平均相对分子质量不再改变,证明反应达到化学平衡状态
②前10min内CO的平均反应速率为0.03mol/(L•min),达平衡时NO的转化率为75%,能使上述平衡体系中$\frac{n(C{O}_{2})}{n(NO)}$增大的措施有降低温度或加压或增大CO的物质的量或从体系中分离出N2(任写一条).
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表(单位省略):
①室温条件下.用敞口容器加热氨水一段时间,恢复至室温后,溶液中水的电离程度比加热前增大(填写“增大”、“减小”或“不变”).
②常温下,测得某碳酸饮料的pH=6,则该饮料$\frac{n(C{O}_{3}^{2-})}{n(HC{O}_{3}^{-})}$=5.6×10-5.

(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:
写出CO2(g)与C(s)反应生成CO(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(2)汽车尾气净化过程中发生反应2NO(g)+2CO(g)?N2+2CO2(g)△H<0.一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L,(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图2所示曲线.
①下列关于上述反应过程的叙述正确的是AD(填写字母代号).
A.其它条件不变,加入催化剂,△H的值不变
B.及时除去二氧化碳,反应的正反应速率加快
C.NO、CO、N2、CO2浓度均不再变化,说明未达到平衡状态
D.混合气体的平均相对分子质量不再改变,证明反应达到化学平衡状态
②前10min内CO的平均反应速率为0.03mol/(L•min),达平衡时NO的转化率为75%,能使上述平衡体系中$\frac{n(C{O}_{2})}{n(NO)}$增大的措施有降低温度或加压或增大CO的物质的量或从体系中分离出N2(任写一条).
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表(单位省略):
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 1.7×10-5 |
②常温下,测得某碳酸饮料的pH=6,则该饮料$\frac{n(C{O}_{3}^{2-})}{n(HC{O}_{3}^{-})}$=5.6×10-5.
18.某学生用 Na2CO3和 KHCO3 组成的某混合物进行实验,测得如表数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)下列有关的说法中,正确的是( )
| 实验序号 | ① | ② | ③ | ④ |
| 盐酸体积/mL | 50 | 50 | 50 | 50 |
| 固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
| 生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
| A. | 盐酸的物质的量浓度为 2 mol•L-1 | |
| B. | 原混合物样品中 n(Na2CO3):n(KHCO3)=1:1 | |
| C. | 实验②中,混合物过量 | |
| D. | 实验④反应后,至少需继续加入 40ml 的该盐酸溶液才能把12.24g 的混合物全部反应 |
5.图1是硫元素在自然界的循环情况.
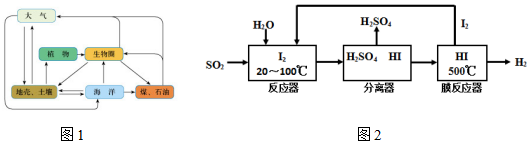
(1)有关叙述中不正确的是ac(填序号)
a.自然界不存在游离态的硫
b.部分硫元素由地壳到大气的过程发生了氧化反应
c.图1显示大气中的二氧化硫最终回到海洋并很快和其它矿物形成煤和石油
d.葡萄酒中含有二氧化硫可防止葡萄酒被氧化
(2)硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2而获得清洁能源.
①该循环工艺过程的总反应方程式为SO2+2H2O=H2+H2SO4.
②FeS2可和盐酸发生复分解反应生成一种不稳定的液态化合物,该化合物的电子式
③用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是减小生成物浓度,平衡正向移动,提高HI的分解率.
④已知下列三个反应:
a Cl(g)+H(g)═HCl(g)△H1 b Br(g)+H(g)═HBr(g)△H2 c I(g)+H(g)═HI(g)△H3
则△H1、△H2、△H3由大到小的顺序为△H3>△H2>△H1,用原子结构解释原因Cl、Br、I为同主族元素,从上至下,原子半径依次知道,非金属性依次减弱,氢化物稳定性依次减弱.
(3)工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.
表是不同压强、温度时SO2的转化率情况.
工业中SO2转化为SO3通常采用400℃~500℃、压强1.0MPa,而不选择更高的10MPa.其原因是压强增大10倍,转化率几乎不变.
(4)下列事实能说明H2SO3的酸性强于H2CO3的是b
a.饱和H2SO3溶液的pH小于饱和H2CO3溶液的pH.
b.同温下,等浓度的NaHSO3和NaHCO3溶液,后者的pH值大.
c.H2SO3能使酸性高锰酸钾溶液褪色,而H2CO3不能.
d.将过量SO2气体通入NaHCO3溶液中,逸出的气体能使澄清石灰水变浑浊.

(1)有关叙述中不正确的是ac(填序号)
a.自然界不存在游离态的硫
b.部分硫元素由地壳到大气的过程发生了氧化反应
c.图1显示大气中的二氧化硫最终回到海洋并很快和其它矿物形成煤和石油
d.葡萄酒中含有二氧化硫可防止葡萄酒被氧化
(2)硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2而获得清洁能源.
①该循环工艺过程的总反应方程式为SO2+2H2O=H2+H2SO4.
②FeS2可和盐酸发生复分解反应生成一种不稳定的液态化合物,该化合物的电子式

③用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是减小生成物浓度,平衡正向移动,提高HI的分解率.
④已知下列三个反应:
a Cl(g)+H(g)═HCl(g)△H1 b Br(g)+H(g)═HBr(g)△H2 c I(g)+H(g)═HI(g)△H3
则△H1、△H2、△H3由大到小的顺序为△H3>△H2>△H1,用原子结构解释原因Cl、Br、I为同主族元素,从上至下,原子半径依次知道,非金属性依次减弱,氢化物稳定性依次减弱.
(3)工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.
表是不同压强、温度时SO2的转化率情况.
压强 温度℃ | 0.2Mpa | 1.0Mp | 10Mpa |
| 400 | 97.2% | 99.5% | 99.7% |
| 500 | 91.5% | 96.9% | 97.8% |
| 600 | 72.6% | 85.8% | 89.5% |
(4)下列事实能说明H2SO3的酸性强于H2CO3的是b
a.饱和H2SO3溶液的pH小于饱和H2CO3溶液的pH.
b.同温下,等浓度的NaHSO3和NaHCO3溶液,后者的pH值大.
c.H2SO3能使酸性高锰酸钾溶液褪色,而H2CO3不能.
d.将过量SO2气体通入NaHCO3溶液中,逸出的气体能使澄清石灰水变浑浊.
2.全氮类物质具有高密度、超高能量及爆轰产物无污染等优点.中国科学家成功合成全氮阴离子N5-,N5-是制备全氮类物质N5+N5-的重要中间体.下列说法中,不正确的是( )
| A. | 全氮类物质属于绿色能源 | B. | 每个N5+中含有35个质子 | ||
| C. | 每个N5-中含有35个电子 | D. | N5+N5-结构中含共价键 |
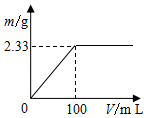 分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.
分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.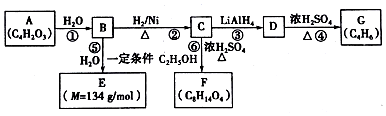
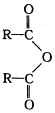 $\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
$\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)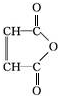 .
.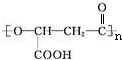 .有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.
.有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.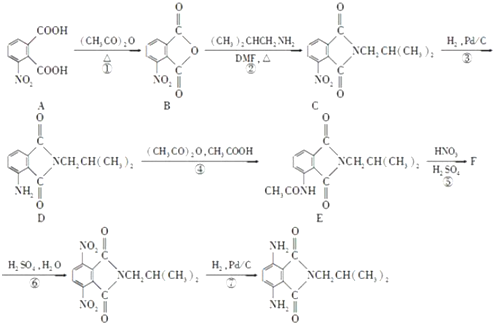
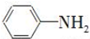 )有还原性,易被氧化;
)有还原性,易被氧化;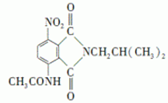 .
.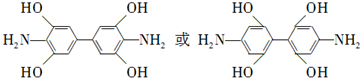 .
.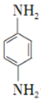 是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下: