题目内容
15.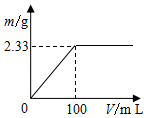 分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.
分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图.混合物中n[(NH4)2SO4]:n(NH4Cl)为1:2.
(2)另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-=0.1mol/L(溶液体积变化忽略不计).
分析 (1)分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份,而第一份加100ml的氢氧化钡生成沉淀硫酸钡的质量为2.33g,其物质的量为:$\frac{2.33g}{233g/mol}$=0.01mol,根据硫酸根离子守恒,所以第一份中硫酸铵的物质的量为0.01mol,其质量为:0.01×132=1.32g,则每份中NH4Cl的质量为:2.39-1.32=1.07g,所以氯化铵的物质的量为$\frac{1.07g}{53.5g/mol}$=0.02mol;
(2)由(1)可知100ml氢氧化钡的物质的量为:0.01mol,所以氢氧化钡的浓度为$\frac{0.01mol}{0.1L}$=0.1mol/L,而2.39g(NH4)2SO4和NH4Cl固体混合物中铵根离子的物质的量为:0.01×2+0.02=0.04mol,根据NH4++OH-=NH3↑+H2O可知氢氧化钡的物质的量为:0.02mol,所以需氢氧化钡的体积为:$\frac{0.02}{0.1}$=0.2L,根据c=$\frac{n}{V}$求氯离子的物质的量浓度.
解答 解:(1)分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份,而第一份加100ml的氢氧化钡生成沉淀硫酸钡的质量为2.33g,其物质的量为:$\frac{2.33g}{233g/mol}$=0.01mol,根据硫酸根离子守恒,所以第一份中硫酸铵的物质的量为0.01mol,其质量为:0.01×132=1.32g,则每份中NH4Cl的质量为:2.39-1.32=1.07g,所以氯化铵的物质的量为$\frac{1.07g}{53.5g/mol}$=0.02mol,所以两者的物质的量之比为:0.01:0.02=1:2,故答案为:1:2;
(2)由(1)可知100ml氢氧化钡的物质的量为:0.01mol,所以氢氧化钡的浓度为$\frac{0.01mol}{0.1L}$=0.1mol/L,而2.39g(NH4)2SO4和NH4Cl固体混合物中铵根离子的物质的量为:0.01×2+0.02=0.04mol,根据NH4++OH-=NH3↑+H2O可知氢氧化钡的物质的量为:0.02mol,所以需氢氧化钡的体积为:$\frac{0.02}{0.1}$=0.2L,c=$\frac{n}{V}$=$\frac{0.02}{0.2}$=0.1mol/L,故答案为:0.1mol/L.
点评 本题考查混合物的有关计算,注意利用守恒法解答,侧重对基础知识的巩固.

| A. | 在标准状况下,78g苯的碳碳双键数目为3NA | |
| B. | 1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价健数均为4NA | |
| C. | 500mL2mol/LNH4NO3溶液中,含有氮原子数目为2NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子数效目一定为NA |
| A. | 1molFeCl3跟沸水反应转化成氢氧化铁胶体后,生成胶体微粒的数目为NA | |
| B. | 电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 | |
| C. | 6.8克熔融的KHSO4中含有0.1NA个阳离子 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
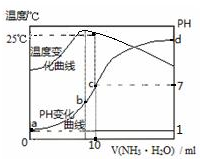
| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH4+)=c(Cl-)=1.0mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)=(n-1)×10-7 |
| A. | LiH跟水反应后的溶液显中性 | B. | LiH在化学反应中是一种强氧化剂 | ||
| C. | LiH中氢离子可以被还原成氢气 | D. | LiH中氢离子半径比锂离子半径大 |
| A. | 人工分子筛(多孔硅铝酸盐)可以用作吸附剂和催化剂 | |
| B. | 硅胶可以用作食品、药品的干燥剂 | |
| C. | 利用风能、太阳能等能源代替化石燃料,有利于节约能源保护环境 | |
| D. | 蚕丝、腈纶和涤纶既属于化学纤维又属于高分子化合物 |
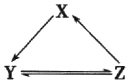 下表所列各组物质中,物质之间通过一步反应不能实砚如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应不能实砚如图所示转化的是( )| 选项 | X | Y | Z |
| A | Na | NaOH | NaCl |
| B | Si | SiO2 | Na2SiO3 |
| C | Cl2 | HClO | NaClO |
| D | NO | NO2 | HNO3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | HCHO | B. | CH3COOCH2CH3 | C. | HOOCCOOH | D. | HCOOH |