题目内容
混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是( )
| A、向CuSO4溶液中加入适量铁粉 |
| B、等物质的量浓度、等体积的Na2SO4与BaCl2溶液 |
| C、等物质的量的NaHCO3与Na2O2固体 |
| D、在NaBr溶液中通入过量氯气 |
考点:氯气的化学性质,常见金属的活动性顺序及其应用,钠的重要化合物
专题:
分析:A.反应生成硫酸亚铁和Cu;
B.等物质的量浓度、等体积,则物质的量相同,二者反应生成硫酸钡和NaCl;
C.等物质的量的NaHCO3与Na2O2固体混合,发生2NaHCO3
Na2CO3+H2O+CO2↑,过氧化钠再与二氧化碳、水反应;
D.向NaBr的溶液中通入过量的氯气,生成氯化钠和溴单质.
B.等物质的量浓度、等体积,则物质的量相同,二者反应生成硫酸钡和NaCl;
C.等物质的量的NaHCO3与Na2O2固体混合,发生2NaHCO3
| ||
D.向NaBr的溶液中通入过量的氯气,生成氯化钠和溴单质.
解答:
解:A.向CuSO4溶液中加入适量铁粉,一定生成硫酸亚铁,无论Fe是否过量,产物均为混合物,故A不选;
B.等物质的量浓度、等体积,则物质的量相同,二者反应生成硫酸钡和NaCl,硫酸钡加热不分解,则为混合物,故B不选;
C.等物质的量的NaHCO3与Na2O2固体混合,发生2NaHCO3
Na2CO3+H2O+CO2↑,过氧化钠再与二氧化碳、水反应,蒸干灼烧后的固体为碳酸钠和NaOH,为混合物,故C不选;
D.向NaBr的混合溶液中通入过量的氯气,生成氯化钠溴单质,加热时溴挥发,得到的固体为氯化钠,为纯净物,故D选;
故选D.
B.等物质的量浓度、等体积,则物质的量相同,二者反应生成硫酸钡和NaCl,硫酸钡加热不分解,则为混合物,故B不选;
C.等物质的量的NaHCO3与Na2O2固体混合,发生2NaHCO3
| ||
D.向NaBr的混合溶液中通入过量的氯气,生成氯化钠溴单质,加热时溴挥发,得到的固体为氯化钠,为纯净物,故D选;
故选D.
点评:本题综合考查物质的性质、发生的化学反应以及分离等操作,侧重于学生的分析能力、实验能力和基础知识的综合运用,为高考常见题型,题目难度中等,选项C为解答的难点.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
在相同温度下,先在1L密闭容器中充入1mol H2(g)和1mol 的I2(g),发生反应 H2(g)+I2(g)?2HI(g);再在2L的另一密闭容器中充入1mol HI(g),发生反应:HI(g)?
H2(g)+
I2(g),达到平衡时,两容器中HI的体积分数为50%,则两者的平衡常数( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、前者大 | B、前者小 |
| C、相等 | D、无法比较 |
在相同温度和体积均为1L的三个密闭容器中,保持温度和容积不变,以三种不同的投料方式进行反应,平衡时有关数据如下(已知相同条件下2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol),下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 起始投入量 | 2mol SO2和1mol O2 | 2mol SO3 | 2mol SO2和2mol O2 |
| 反应放出或吸收的 热量(kJ) | Q1 | Q2 | Q3 |
| 平衡时SO3的物质的量 | n1 | n2 | n3 |
| 平衡转化率 | |||
| 平衡时压强 | p1 | p2 | p3 |
| A、Q1=Q2>Q3 |
| B、n2>n1>n3 |
| C、a1+a2=1 |
| D、p1>p2>p3 |
向一定量的Cu、Fe2O3的混合物中加入100mL 1mol?L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
| A、3.2 g |
| B、2.4 g |
| C、1.6 g |
| D、0.8 g |
下图是用球棍模型表示的某有机反应的过程,则该反应的有机反应类型是( )


| A、取代反应 | B、加成反应 |
| C、聚合反应 | D、酯化反应 |
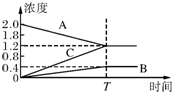 如图的曲线是800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是平衡的时间,能以此曲线表示的反应是( )
如图的曲线是800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是平衡的时间,能以此曲线表示的反应是( )| A、2A?B+3C |
| B、B+3C?2A |
| C、A+C?B |
| D、B?A+C |
下列各反应中,水作为还原剂的是( )
| A、2H2+O2=2H2O |
| B、SO3+H2O=H2SO4 |
| C、2F2+2H2O=4HF+O2 |
| D、2Na+2H2O=2NaOH+H2↑ |
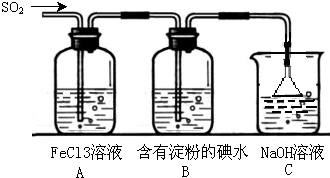 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: