题目内容
某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe2+、Ba2+、SO42-、Cl-、AlO2-,现取该溶液实验如下:
(1)该溶液中一定存在的离子有 ,一定不存在的离子有 ;可能存在的离子有 .
(2)写出下列反应的离子方程式:操作②: .操作④中沉淀溶解: .
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴石蕊试剂 | 溶液变成红色 |
| ②取少量原溶液,加BaCl2溶液 | 有白色沉淀生成 |
| ③取②中上层清液,加AgNO3溶液 | 有白色沉淀生成,且不溶于稀HNO3 |
| ④取少量原溶液,加NaOH溶液至过量 | 有白色沉淀生成,当NaOH过量时有部分沉淀溶解 |
(2)写出下列反应的离子方程式:操作②:
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:无色溶液中,有色离子不存在,氢氧化铝是两性氧化物,能溶于强碱中,白色且不溶于硝酸的白色沉淀是氯化银或者是硫酸钡,在酸性环境下,能和氢离子反应的离子不共存,根据离子反应的现象以及离子共存的知识加以分析.因是一无色透明溶液,则不含有Fe2+,
①取少量该溶液,加几滴石蕊试液,溶液显红色,说明溶液显示酸性,所以AlO2-不存在;
②取少量该溶液,加BaCl2溶液,有白色沉淀生成,则含有SO42-;
③由于②中加入了氯化钡,无法确定原溶液中是否存在氯离子;
④取少量该溶液,加入NaOH溶液有白色沉淀生成,当NaOH过量时,沉淀部分溶解,则含有铝离子、镁离子.
①取少量该溶液,加几滴石蕊试液,溶液显红色,说明溶液显示酸性,所以AlO2-不存在;
②取少量该溶液,加BaCl2溶液,有白色沉淀生成,则含有SO42-;
③由于②中加入了氯化钡,无法确定原溶液中是否存在氯离子;
④取少量该溶液,加入NaOH溶液有白色沉淀生成,当NaOH过量时,沉淀部分溶解,则含有铝离子、镁离子.
解答:
解:无色溶液中,有色离子不存在,氢氧化铝是两性氧化物,能溶于强碱中,白色且不溶于硝酸的白色沉淀是氯化银或者是硫酸钡,在酸性环境下,能和氢离子反应的离子不共存,根据离子反应的现象以及离子共存的知识加以分析.因是一无色透明溶液,则不含有Fe2+,
①取少量该溶液,加几滴石蕊试液,溶液显红色,说明溶液显示酸性,所以AlO2-不存在;
②取少量该溶液,加BaCl2溶液,有白色沉淀生成,则含有SO42-;
③由于②中加入了氯化钡,无法确定原溶液中是否存在氯离子;
④取少量该溶液,加入NaOH溶液有白色沉淀生成,当NaOH过量时,沉淀部分溶解,则含有铝离子、镁离子.
(1)根据以上分析可知,溶液中一定存在的离子有:SO42- Mg2+、Al3+,溶液中肯定不存在的离子是Ba2+、Fe2+、AlO2-,不能确定的是:Cl-,
故答案为:SO42-、Mg2+、Al3+; Ba2+、Fe2+、AlO2-;Cl-;
(2)钡离子与硫酸根反应生成硫酸钡沉淀,Ba2++SO42-=BaSO4↓,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Ba2++SO42-=BaSO4↓;Al(OH)3+OH-=AlO2-+2H2O.
①取少量该溶液,加几滴石蕊试液,溶液显红色,说明溶液显示酸性,所以AlO2-不存在;
②取少量该溶液,加BaCl2溶液,有白色沉淀生成,则含有SO42-;
③由于②中加入了氯化钡,无法确定原溶液中是否存在氯离子;
④取少量该溶液,加入NaOH溶液有白色沉淀生成,当NaOH过量时,沉淀部分溶解,则含有铝离子、镁离子.
(1)根据以上分析可知,溶液中一定存在的离子有:SO42- Mg2+、Al3+,溶液中肯定不存在的离子是Ba2+、Fe2+、AlO2-,不能确定的是:Cl-,
故答案为:SO42-、Mg2+、Al3+; Ba2+、Fe2+、AlO2-;Cl-;
(2)钡离子与硫酸根反应生成硫酸钡沉淀,Ba2++SO42-=BaSO4↓,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Ba2++SO42-=BaSO4↓;Al(OH)3+OH-=AlO2-+2H2O.
点评:本题考查离子的共存问题,关键是明确题中信息的挖掘和应用,并能够熟悉离子不能共存的常见的原因,本题难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
将下列物质分别投入到FeCl3溶液中,没有气体产生,但有沉淀生成的是( )
| A、Na |
| B、Na2O2 |
| C、Na2O |
| D、NaCl |
为达到下列实验目的,所采用的方法正确的是( )
| A、从溴水中提取溴--分液 |
| B、分离水和汽油的混合物--蒸馏 |
| C、从硝酸钾和氯化钾混合液中获取硝酸钾--蒸发 |
| D、分离饱和食盐水和沙子的混合物--过滤 |
混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是( )
| A、向CuSO4溶液中加入适量铁粉 |
| B、等物质的量浓度、等体积的Na2SO4与BaCl2溶液 |
| C、等物质的量的NaHCO3与Na2O2固体 |
| D、在NaBr溶液中通入过量氯气 |
可逆反应A(g)+B?C(g)+D,达到平衡时,下列说法不正确的是( )
| A、平衡时,单位时间内n(B)消耗﹕n(C)消耗=1﹕1 |
| B、若增大A的浓度,平衡体系颜色加深,D不一定是有颜色的气体 |
| C、升高温度,C百分含量减少,说明正反应是放热反应 |
| D、增大压强,平衡不移动,说明B是气体 |
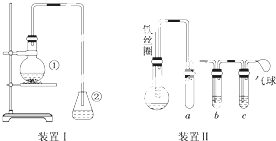 为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验: