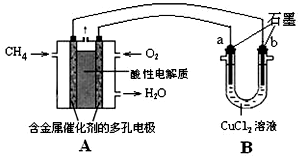
题目内容
在相同温度和体积均为1L的三个密闭容器中,保持温度和容积不变,以三种不同的投料方式进行反应,平衡时有关数据如下(已知相同条件下2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol),下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 起始投入量 | 2mol SO2和1mol O2 | 2mol SO3 | 2mol SO2和2mol O2 |
| 反应放出或吸收的 热量(kJ) | Q1 | Q2 | Q3 |
| 平衡时SO3的物质的量 | n1 | n2 | n3 |
| 平衡转化率 | |||
| 平衡时压强 | p1 | p2 | p3 |
| A、Q1=Q2>Q3 |
| B、n2>n1>n3 |
| C、a1+a2=1 |
| D、p1>p2>p3 |
考点:等效平衡
专题:
分析:恒温恒容下,加入2mol SO2和1mol O2与2mol SO3为等效平衡,达到平衡时甲和乙容器中各组分的浓度、含量完全相同,而丙容器中多加入了1mol氧气,二氧化硫的转化率大于甲的,反应放出的热量、平衡时的总压强、三氧化硫的物质的量都也大于甲的,据此进行解答.
解答:
解:恒温恒容条件下,甲与乙为等效平衡,丙加入的氧气的物质的量大于甲,所以丙中二氧化硫达到转化率、三氧化硫的物质的量及放出的热量大于甲的,
A.由于不知达到平衡时二氧化硫的转化率情况,无法比较Q1与Q2的大小;丙中加入的氧气的物质的量比甲多1mol,所以二氧化硫的转化率丙的大于甲的,反应放出的热量Q3>Q1,故A错误;
B.达到平衡时,甲和乙中三氧化硫的物质的量相等,即n2=n1,丙中二氧化硫的转化率大于甲,所以丙中三氧化硫的物质的量大于甲的,即n3>n1=n2,故B错误;
C.甲和乙是从不同的反应方向进行的等效平衡,且二氧化硫和三氧化硫的化学计量数相等,所以一定满足二者的转化率之和等于1,即 α1+α2=1,故C正确;
D.由于甲和乙为等效平衡,则达到平衡时甲和乙中气体的总物质的量相等,所以容器内的总压强一定相等,即p1=p2;由于丙中进入的氧气的物质的量比甲多出1mol,所以达到平衡时丙中压强最大,即p3>p1=p2,故D错误.
故选C.
A.由于不知达到平衡时二氧化硫的转化率情况,无法比较Q1与Q2的大小;丙中加入的氧气的物质的量比甲多1mol,所以二氧化硫的转化率丙的大于甲的,反应放出的热量Q3>Q1,故A错误;
B.达到平衡时,甲和乙中三氧化硫的物质的量相等,即n2=n1,丙中二氧化硫的转化率大于甲,所以丙中三氧化硫的物质的量大于甲的,即n3>n1=n2,故B错误;
C.甲和乙是从不同的反应方向进行的等效平衡,且二氧化硫和三氧化硫的化学计量数相等,所以一定满足二者的转化率之和等于1,即 α1+α2=1,故C正确;
D.由于甲和乙为等效平衡,则达到平衡时甲和乙中气体的总物质的量相等,所以容器内的总压强一定相等,即p1=p2;由于丙中进入的氧气的物质的量比甲多出1mol,所以达到平衡时丙中压强最大,即p3>p1=p2,故D错误.
故选C.
点评:本题考查了等效平衡的判断及应用、化学平衡的建立过程,题目难度中等,注意明确等效平衡的判断方法,能够利用等效平衡的知识判断各组分的含量、转化率及压强大小等.

练习册系列答案
相关题目
下列关于物质的检验说法不正确的是( )
| A、向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- |
| B、将某化合物进行焰色实验,透过蓝色钴玻璃观察,焰色为紫色,证明含K+ |
| C、待检液逐滴加入NaOH溶液,有白色胶状沉淀产生后来沉淀逐渐消失,则原溶液中可能含有Al3+ |
| D、待检液中先加入KSCN溶液,无明显现象,再加入氯水溶液显血红色,则待检液中一定含有Fe2+ |
混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是( )
| A、向CuSO4溶液中加入适量铁粉 |
| B、等物质的量浓度、等体积的Na2SO4与BaCl2溶液 |
| C、等物质的量的NaHCO3与Na2O2固体 |
| D、在NaBr溶液中通入过量氯气 |
下列各反应属于加成反应的是( )
A、CH4+2O2
| ||
| B、CH2═CH2+Br2→CH2Br-CH2Br | ||
| C、CH4+Cl2→CH3Cl+HCl | ||
| D、2CH3CH2OH+O2→2CH3CHO+2H2O |
已知:C+CO2?2CO,正反应为吸热反应,达到平衡后,改变下列条件,能使平衡常数增大的是( )
| A、升温 | B、加压 |
| C、降温 | D、使用催化剂 |
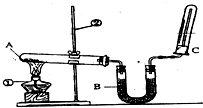 某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:
某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题: