题目内容
在相同温度下,先在1L密闭容器中充入1mol H2(g)和1mol 的I2(g),发生反应 H2(g)+I2(g)?2HI(g);再在2L的另一密闭容器中充入1mol HI(g),发生反应:HI(g)?
H2(g)+
I2(g),达到平衡时,两容器中HI的体积分数为50%,则两者的平衡常数( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、前者大 | B、前者小 |
| C、相等 | D、无法比较 |
考点:化学平衡的计算
专题:化学平衡专题
分析:以及化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算,哟个生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
解答:
解:H2(g)+I2(g)?2HI(g);
起始量(mol/L) 1 1 0
变化量(mol/L) x x 2x
平衡量(mol/L)1-x 1-x 2x
HI的体积分数为50%,
=0.5
x=0.5
K=
=4
HI(g)?
H2(g)+
I2(g),
起始量(mol/L) 0.5 0 0
变化量(mol/L) y 0.5y 0.5y
平衡量(mol/L)0.5-y 0.5y 0.5y
HI的体积分数为50%,
=0.5
y=0.5
K=
=0.5
故A正确;
起始量(mol/L) 1 1 0
变化量(mol/L) x x 2x
平衡量(mol/L)1-x 1-x 2x
HI的体积分数为50%,
| 2x |
| 2 |
x=0.5
K=
| (2×0.5)2 |
| (1-0.5)2 |
HI(g)?
| 1 |
| 2 |
| 1 |
| 2 |
起始量(mol/L) 0.5 0 0
变化量(mol/L) y 0.5y 0.5y
平衡量(mol/L)0.5-y 0.5y 0.5y
HI的体积分数为50%,
| 0.5-y |
| 0.5 |
y=0.5
K=
(0.5×0.5)
| ||||
| 0.5 |
故A正确;
点评:本题考查了平衡常数概念的计算分析应用,掌握平衡计算和平衡常数概念实质是解题关键,题目难度中等.

练习册系列答案
相关题目
保险丝是由武德合金制成的,武的合金是用50%铋、25%的铅、12.5%锡和12.5%的镉制成的,武德合金用于电器业主要是利用武德合金的( )
| A、熔点 | B、硬度 |
| C、稳定性 | D、导电性 |
将下列物质分别投入到FeCl3溶液中,没有气体产生,但有沉淀生成的是( )
| A、Na |
| B、Na2O2 |
| C、Na2O |
| D、NaCl |
混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是( )
| A、向CuSO4溶液中加入适量铁粉 |
| B、等物质的量浓度、等体积的Na2SO4与BaCl2溶液 |
| C、等物质的量的NaHCO3与Na2O2固体 |
| D、在NaBr溶液中通入过量氯气 |
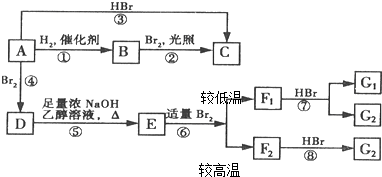
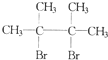 F1和F2为同分异构体,G1和G2互为同分异构体)
F1和F2为同分异构体,G1和G2互为同分异构体)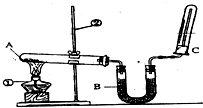 某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:
某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题: