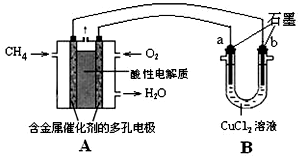
题目内容
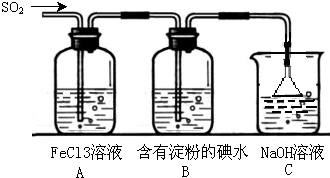 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在浓盐酸中,再加水稀释,这样操作的目的是
(2)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、
序号).
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯E.玻璃棒 F. 坩埚
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式
②请设计实验方案检验有Fe2+生成
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-.该做法
(4)能表明I-的还原性弱于SO2的现象是
考点:性质实验方案的设计,氧化性、还原性强弱的比较
专题:
分析:(1)三价铁离子水解显酸性;
(2)从溶液中获得晶体的操作为:蒸发、冷却结晶、过滤、自然干燥;蒸发用蒸发皿和玻璃杯,过滤用漏斗、烧杯、玻璃棒;
(3)①SO2与FeCl3溶液反应 SO2被氧化为SO42-,三价铁离子被还原为亚铁离子;
②检验亚铁离子用KSCN溶液和氯水;
③硝酸具有强氧化性,能氧化SO32-;
(4)碘单质与二氧化硫反应,则淀粉溶液褪色.
(2)从溶液中获得晶体的操作为:蒸发、冷却结晶、过滤、自然干燥;蒸发用蒸发皿和玻璃杯,过滤用漏斗、烧杯、玻璃棒;
(3)①SO2与FeCl3溶液反应 SO2被氧化为SO42-,三价铁离子被还原为亚铁离子;
②检验亚铁离子用KSCN溶液和氯水;
③硝酸具有强氧化性,能氧化SO32-;
(4)碘单质与二氧化硫反应,则淀粉溶液褪色.
解答:
解:(1)三价铁离子水解显酸性,所以在配制氯化铁溶液时,需先把氯化铁晶体溶解在浓盐酸中,抑制氯化铁水解,再加水稀释;
故答案为:抑制氯化铁水解;
(2)从溶液中获得晶体的操作为:蒸发、冷却结晶、过滤、自然干燥;蒸发用蒸发皿和玻璃杯,过滤用漏斗、烧杯、玻璃棒,所以在这一系列操作中没有用到的仪器有石棉网和坩埚;
故答案为:过滤;BF;
(3)①SO2与FeCl3溶液反应 SO2被氧化为SO42-,三价铁离子被还原为亚铁离子,其反应的离子方程式为:2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;
故答案为:2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;
②检验亚铁离子用KSCN溶液和氯水,取少量A中反应后的溶液于试管中,滴入2~3滴KSCN溶液,溶液不变红,说明没有三价铁离子,再加氯水,溶液变红色,说明含有Fe2+;故答案为:取少量A中反应后的溶液于试管中,滴入2~3滴KSCN溶液,不变红,再加入新制的氯水,溶液变红;
③向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,能氧化SO2为SO42-,会干扰实验;
故答案为:不合理;硝酸可以将溶解的SO2(或亚硫酸)氧化为 H2SO4,干扰实验;
(4)把二氧化硫通入含有淀粉的碘水中,碘单质与二氧化硫反应生成HI,则淀粉溶液蓝色褪去,所以B中蓝色溶液褪色,即说明了I-的还原性弱于SO2,
故答案为:B中蓝色溶液褪色.
故答案为:抑制氯化铁水解;
(2)从溶液中获得晶体的操作为:蒸发、冷却结晶、过滤、自然干燥;蒸发用蒸发皿和玻璃杯,过滤用漏斗、烧杯、玻璃棒,所以在这一系列操作中没有用到的仪器有石棉网和坩埚;
故答案为:过滤;BF;
(3)①SO2与FeCl3溶液反应 SO2被氧化为SO42-,三价铁离子被还原为亚铁离子,其反应的离子方程式为:2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;
故答案为:2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;
②检验亚铁离子用KSCN溶液和氯水,取少量A中反应后的溶液于试管中,滴入2~3滴KSCN溶液,溶液不变红,说明没有三价铁离子,再加氯水,溶液变红色,说明含有Fe2+;故答案为:取少量A中反应后的溶液于试管中,滴入2~3滴KSCN溶液,不变红,再加入新制的氯水,溶液变红;
③向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,能氧化SO2为SO42-,会干扰实验;
故答案为:不合理;硝酸可以将溶解的SO2(或亚硫酸)氧化为 H2SO4,干扰实验;
(4)把二氧化硫通入含有淀粉的碘水中,碘单质与二氧化硫反应生成HI,则淀粉溶液蓝色褪去,所以B中蓝色溶液褪色,即说明了I-的还原性弱于SO2,
故答案为:B中蓝色溶液褪色.
点评:本题考查较综合,涉及氧化还原反应及实验探究,侧重学生分析能力和实验能力的考查,注意二氧化硫的性质、亚铁离子的检验方法等知识,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
保险丝是由武德合金制成的,武的合金是用50%铋、25%的铅、12.5%锡和12.5%的镉制成的,武德合金用于电器业主要是利用武德合金的( )
| A、熔点 | B、硬度 |
| C、稳定性 | D、导电性 |
为达到下列实验目的,所采用的方法正确的是( )
| A、从溴水中提取溴--分液 |
| B、分离水和汽油的混合物--蒸馏 |
| C、从硝酸钾和氯化钾混合液中获取硝酸钾--蒸发 |
| D、分离饱和食盐水和沙子的混合物--过滤 |
混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是( )
| A、向CuSO4溶液中加入适量铁粉 |
| B、等物质的量浓度、等体积的Na2SO4与BaCl2溶液 |
| C、等物质的量的NaHCO3与Na2O2固体 |
| D、在NaBr溶液中通入过量氯气 |
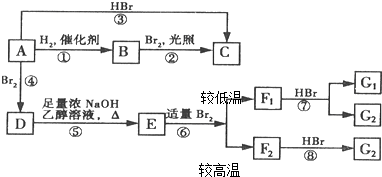
 F1和F2为同分异构体,G1和G2互为同分异构体)
F1和F2为同分异构体,G1和G2互为同分异构体)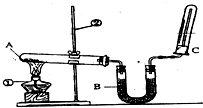 某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:
某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题: